Содержание
- 2. Вспомните: На какие две группы принято разделять все химические элементы?
- 3. Подумайте: По какому основному признаку химические элементы делятся на металлы и неметаллы?
- 4. С точки зрения теории строения атомов принадлежность элементов к металлам и неметаллам определяется способностью их атомов
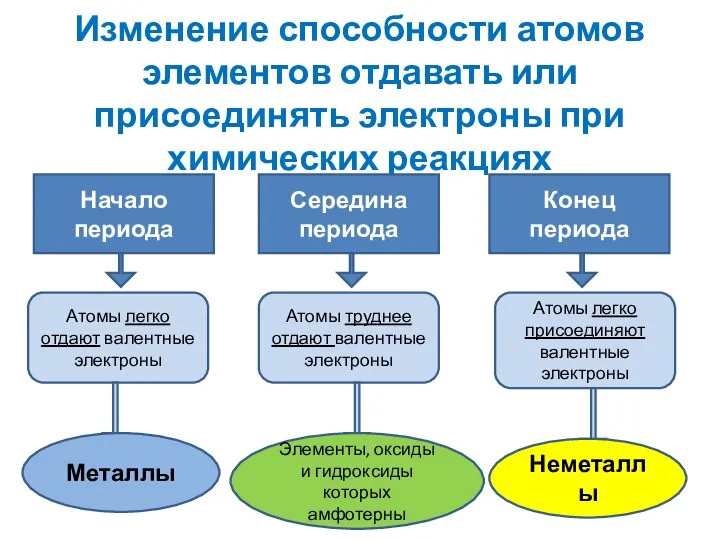
- 5. Следовательно, Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны.
- 6. Неметаллические свойства особенно выражены у тех элементов, атомы которых энергично присоединяют электроны
- 7. Для характеристики способности атомов присоединять или отдавать электроны в химии используют понятие……………….
- 8. Электроотрицательность
- 9. Запиши определение в тетрадь Свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов
- 10. Зная численное значение электроотрицательности элемента, можно судить о его принадлежности к металлам или неметаллам. У металлов
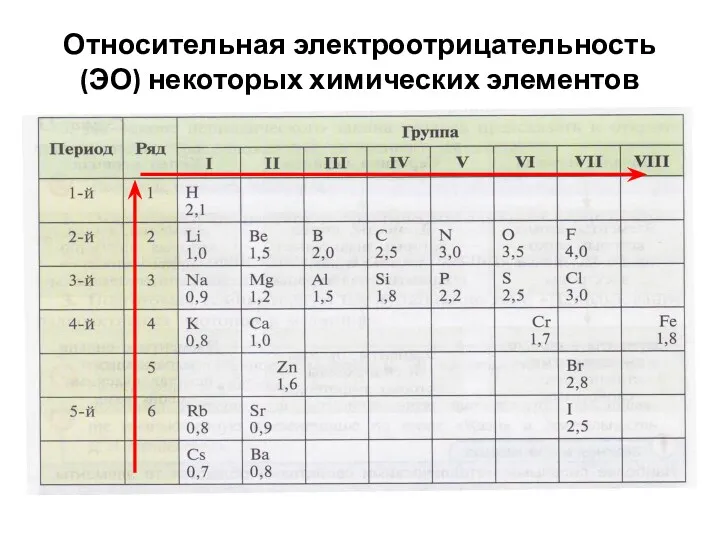
- 11. Задание Изучи таблицу и назови элемент с наиболее выраженными неметаллическими свойствами.
- 12. Относительная электроотрицательность (ЭО) некоторых химических элементов
- 13. Важно знать! Изменение электроотрицательности (ЭО) химических элементов: В периодах электроотрицательность (ЭО) увеличивается слева направо. В главных
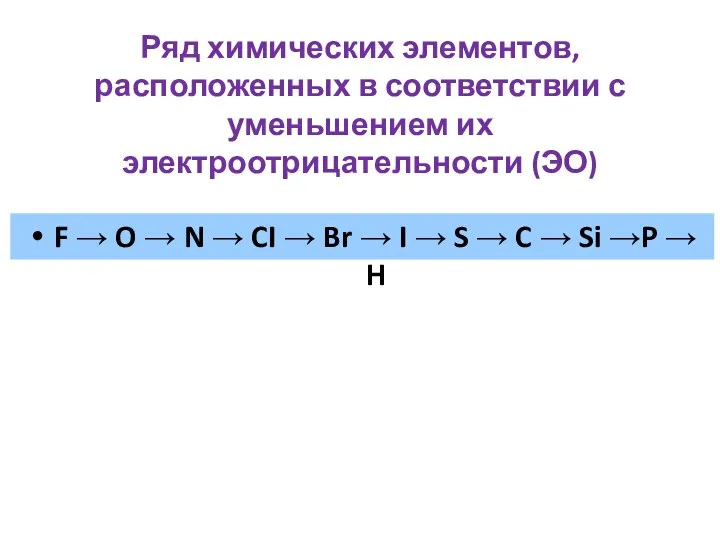
- 14. Ряд химических элементов, расположенных в соответствии с уменьшением их электроотрицательности (ЭО) F → O → N
- 15. Изменение способности атомов элементов отдавать или присоединять электроны при химических реакциях Начало периода Середина периода Конец
- 16. Выполни тест: В ряду C – N – O – F электроотрицательность: увеличивается уменьшается не изменяется
- 17. Важно понять! При образовании химической связи электроны переходят или смещаются к атомам элементов, обладающих большей электроотрицательностью.
- 18. Подумайте Как зависит электроотрицательность элемента от радиуса атома?
- 19. Выводы: Электроотрицательность (ЭО) – это важное свойство атомов химических элементов. Зная электроотрицательность (ЭО) элемента, можно определить
- 20. Подумай и ответь: А. Cs Б. H В. Br Г. F Д. O Какой из элементов
- 21. Проверь свои ответы: 1) А 2) Г 3) А, Б 4) В, Г 5) А
- 22. Атомы благородных газов (инертных) имеют завершённый (устойчивый) внешний энергетический уровень. Атомы других элементов пытаются приобрести конфигурацию
- 23. Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы
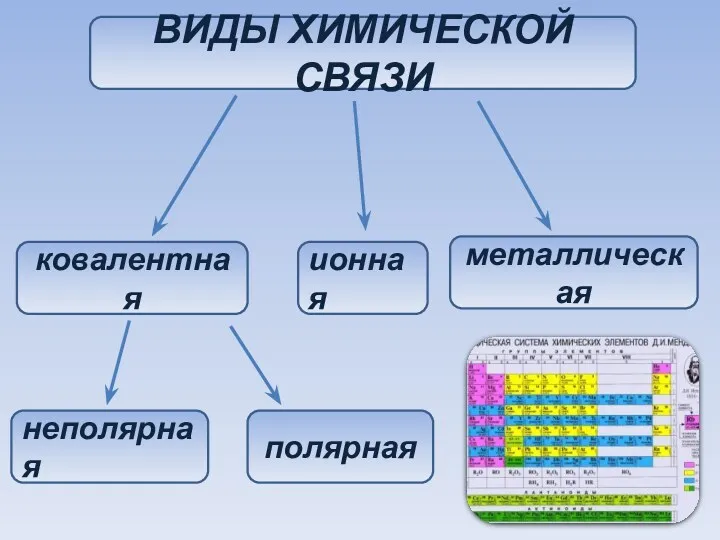
- 24. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ ковалентная ионная металлическая неполярная полярная
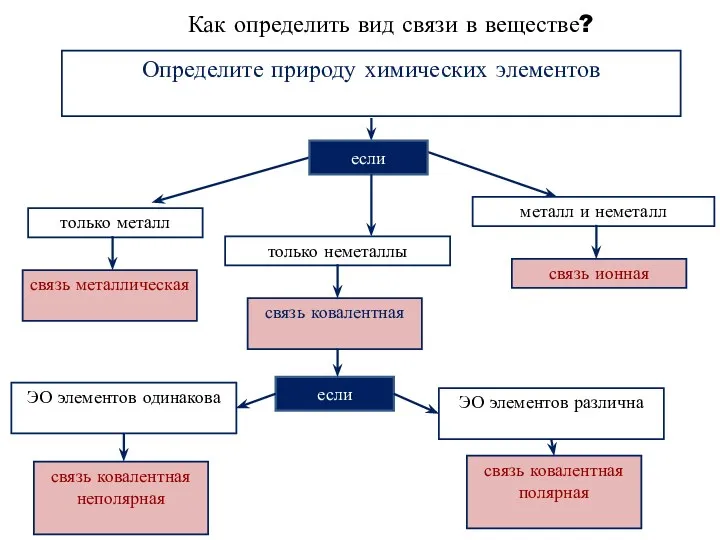
- 25. Как определить вид связи в веществе? Определите природу химических элементов если только металл только неметаллы металл
- 26. Al Na Ba Fe Mg Металлическая – в простых веществах-металлах
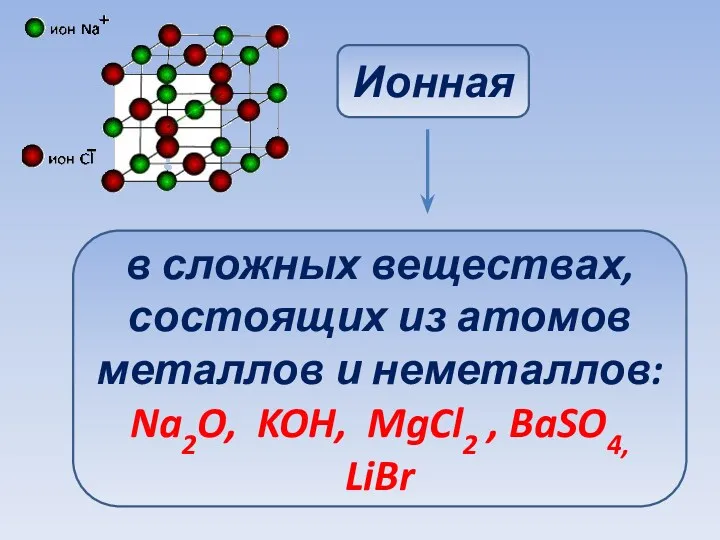
- 27. Ионная в сложных веществах, состоящих из атомов металлов и неметаллов: Na2O, KOH, MgCl2 , BaSO4, LiBr
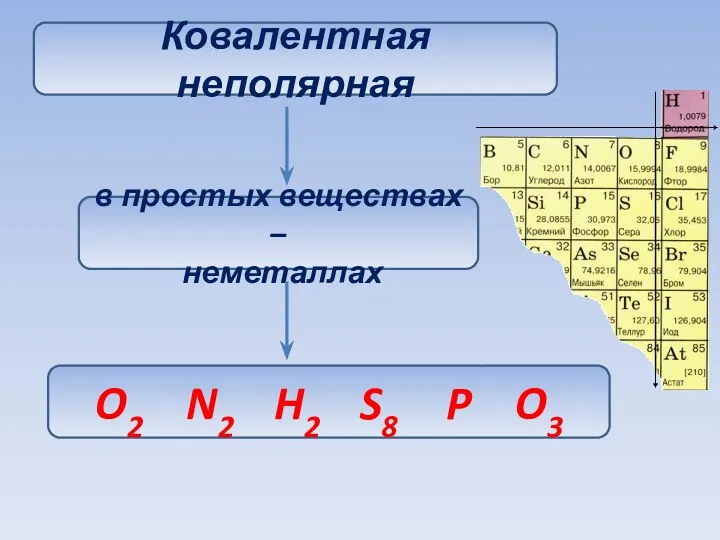
- 28. Ковалентная неполярная в простых веществах – неметаллах O2 N2 H2 S8 P O3
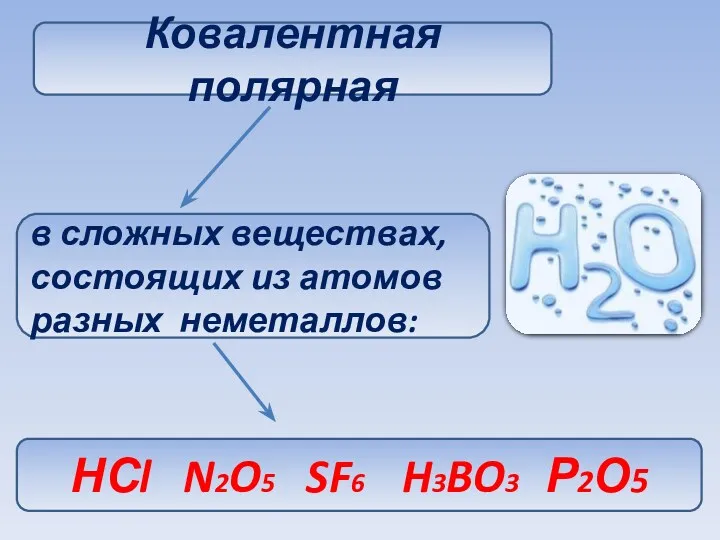
- 29. Ковалентная полярная в сложных веществах, состоящих из атомов разных неметаллов: НСl N2O5 SF6 H3BO3 Р2О5
- 30. H2S N2 LiCl BaO Ca(NO3)2 Pb F2 Определите вид химической связи в каждом из данных соединений
- 32. Скачать презентацию





















 Альдегиды и кетоны. Лекция 10
Альдегиды и кетоны. Лекция 10 Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях Химические свойства алканов
Химические свойства алканов Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Электронное строение атома
Электронное строение атома Белки. Строение
Белки. Строение Минеральные вяжущие вещества, материалы и изделия на их основе
Минеральные вяжущие вещества, материалы и изделия на их основе химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя
химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Катионы І - ІІІ аналитических групп
Катионы І - ІІІ аналитических групп Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Минералы и горные породы
Минералы и горные породы Общая характеристика неметаллов
Общая характеристика неметаллов Методика обучения и воспитания на уроках химии
Методика обучения и воспитания на уроках химии Многоатомные и одноатомные спирты
Многоатомные и одноатомные спирты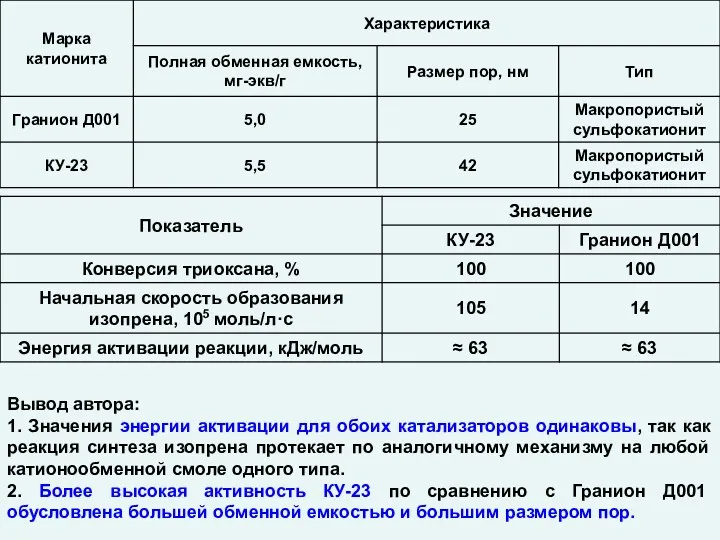 Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Коррозия металлов. Способы защиты металлов от коррозии
Коррозия металлов. Способы защиты металлов от коррозии Основы термодинамики
Основы термодинамики Химическая связь. 8 класс
Химическая связь. 8 класс Электронный помощник по химии (8 класс)
Электронный помощник по химии (8 класс) Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Химические формулы. Относительная молекулярная масса вещества
Химические формулы. Относительная молекулярная масса вещества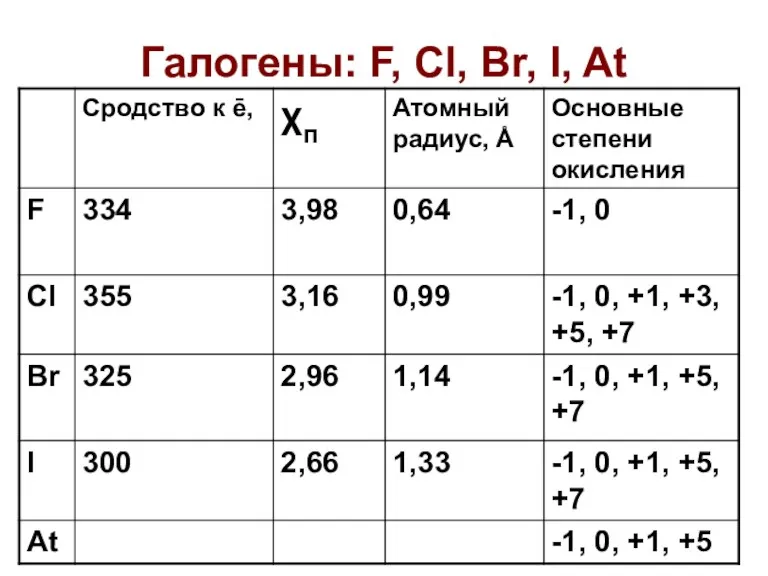 Галогены: F, Cl, Br, I, At
Галогены: F, Cl, Br, I, At Оксиды. Физические свойства
Оксиды. Физические свойства Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Химические свойства алканов
Химические свойства алканов Гипергенез и почвообразование
Гипергенез и почвообразование