Содержание
- 2. Спирты
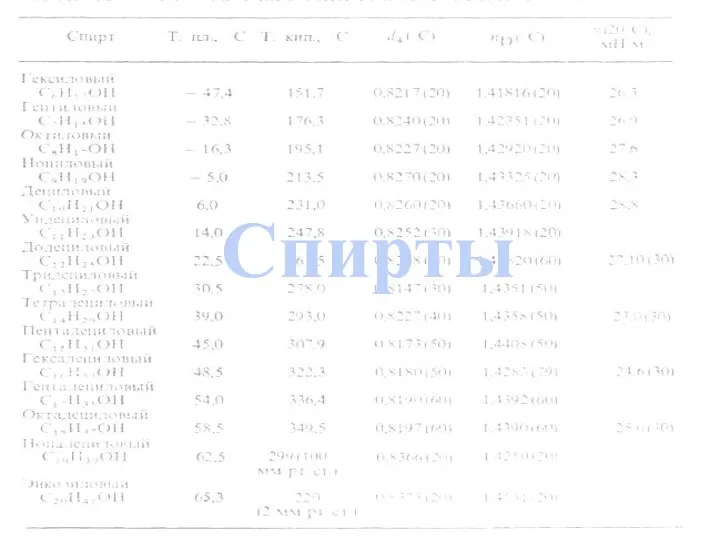
- 3. Одноатомные спирты Номенклатура Получение Физические свойства Гомология Строение Применение Изомерия Химические свойства Многоатомные спирты Автор
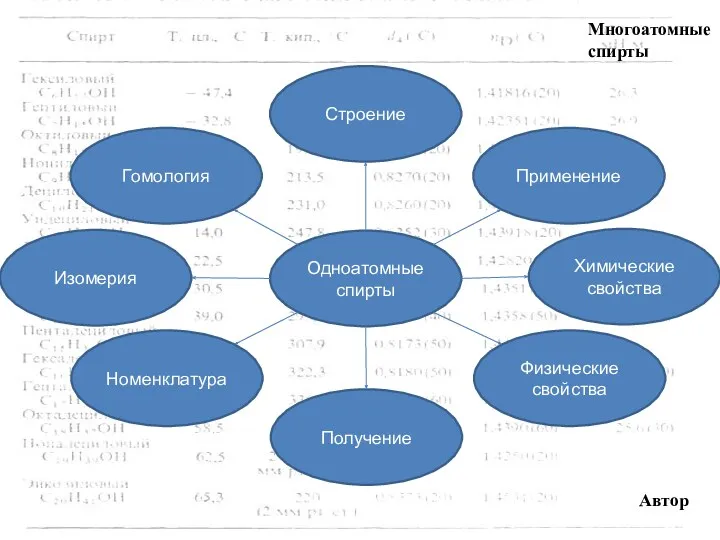
- 4. Многоатомные спирты Получение Номенклатура Получение Физические свойства Строение Применение Изомерия Химические свойства Одноатомные спирты Автор
- 5. Одноатомные спирты — органические соединения, содержащие одну гидроксильную группу (групп −OH), связанных с углеводородным радикалом. Формула:
- 6. Общая формула веществ гомологического ряда предельных одноатомных спиртов: R-ОН. Гомология
- 7. Начиная с третьего члена гомологического ряда у спиртов появляется изомерия положения функциональной группы, а с четвертого
- 8. При образовании названий спиртов к названию углеводорода добавляют суффикс- ол. Цифрами после суффикса указывают положение гидроксильной
- 9. Реакции окисления — основаны на окислении углеводородов (реже — галогенпроизводных углеводородов), содержащих кратные или активированные C−H
- 10. Спирты, содержащие от одного до одиннадцати атомов углерода в молекуле-жидкости, от двенадцати атомов в молекуле -твердые
- 11. Химические свойства спиртов различны и зависят от углеводородных радикалов Спирты взаимодействуют с щелочными и щелочноземельными металлами,
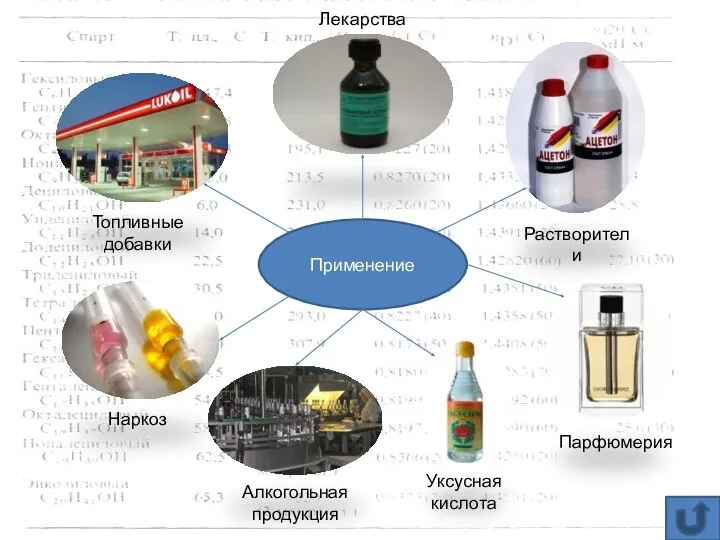
- 12. Применение Топливные добавки Лекарства Растворители Наркоз Алкогольная продукция Уксусная кислота Парфюмерия
- 13. Одноатомные спирты — органические соединения, содержащие две или более гидроксильных групп (групп −OH), связанных с углеводородным
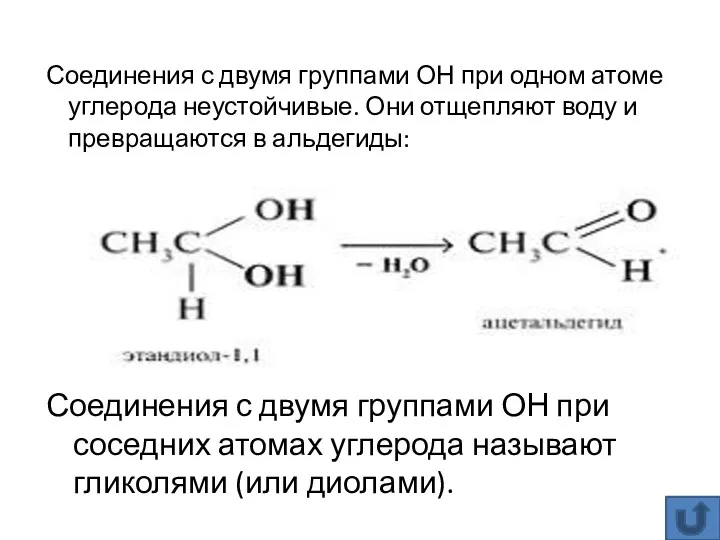
- 14. Соединения с двумя группами ОН при соседних атомах углерода называют гликолями (или диолами). Соединения с двумя
- 15. Начиная с третьего члена гомологического ряда у спиртов появляется изомерия положения функциональной группы, а с четвертого
- 16. При образовании названий спиртов к названию углеводорода добавляют суффикс- ол. Цифрами после суффикса указывают положение гидроксильной
- 17. Получение Гликоли получают окислением алкенов в водной среде. Например, при действии перманганата калия или кислорода воздуха
- 18. Другой способ получения многоатомных спиртов – гидролиз галогенпроизводных углеводородов:
- 19. На производстве глицерин получают по схеме:
- 20. Физические свойства Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. – сладкий).
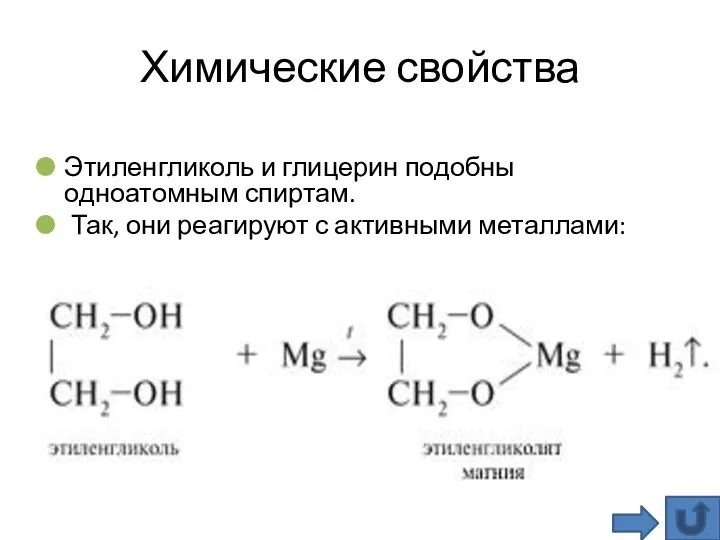
- 21. Химические свойства Этиленгликоль и глицерин подобны одноатомным спиртам. Так, они реагируют с активными металлами:
- 22. Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:
- 23. Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения
- 24. Качественная реакция многоатомных спиртов, позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В
- 26. Скачать презентацию

















 Химия в жизни общества
Химия в жизни общества Organic molecules
Organic molecules Первичная переработка нефти
Первичная переработка нефти Состав газированной воды
Состав газированной воды Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Галогены (солеобразующие)
Галогены (солеобразующие) Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями
Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп Углекислый газ
Углекислый газ Неон. Получение
Неон. Получение Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
 Химическая связь
Химическая связь Углеводы Cn(H2O)m
Углеводы Cn(H2O)m Генетическая связь между классами органических веществ
Генетическая связь между классами органических веществ Типы химических реакций в органической химии
Типы химических реакций в органической химии СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ
СПЛАВЫ. КОРРОЗИЯ МЕТАЛЛОВ Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Хімічні сполуки у побуті
Хімічні сполуки у побуті Основные классы неорганических веществ
Основные классы неорганических веществ Мир первозданной красоты. Природные уникумы Урала
Мир первозданной красоты. Природные уникумы Урала Химический элемент и вещество
Химический элемент и вещество Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Превращения веществ. Роль химии в жизни человека
Превращения веществ. Роль химии в жизни человека Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива
Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива