Содержание
- 2. Термодинамика - это наука, изучающая взаимные превращения различных видов энергии, связанные с переходом энергии в форме
- 3. Основные понятия и термины Термодинамическая система (ТД система) - это любой объект природы, состоящий из достаточно
- 4. Основные понятия химической термодинамики Часть объектов природы, не входящих в систему, называется средой. Важными характеристиками системы
- 5. Открытая система (живой организм) Закрытая система (запаянная ампула с лекарством) Изолированная система (термос) Классификация систем по
- 6. Основные понятия химической термодинамики Фаза - это часть системы с одинаковыми физическими и химическими свойствами, отделенная
- 7. Основные понятия химической термодинамики В зависимости от фазового состояния различают: 1. Гомогенные системы. Это системы, в
- 8. Основные понятия химической термодинамики Термодинамическое состояние системы - совокупность всех физических и химических свойств системы. Качественно
- 9. Основные понятия химической термодинамики
- 10. Основные понятия химической термодинамики Термодинамические параметры называются стандартными, если они определяются при стандартных условиях. К стандартным
- 11. Основные понятия химической термодинамики Термодинамический процесс - переход системы из одного равновесного состояния в другое, сопровождающийся
- 12. Основные понятия химической термодинамики В зависимости от того, какой из параметров состояния при протекании термодинамического процесса
- 13. Функции состояния системы В термодинамике для определения изменения энергии системы пользуются различными энергетическими характеристиками, которые называются
- 14. Функции состояния системы К термодинамическим функциям системы относятся: 1. Внутренняя энергия (U). 2. Энтальпия (Н). 3.
- 15. Функции состояния системы 1. Внутренняя энергия (U) Внутренняя энергия системы складывается из кинетической энергии движения молекул
- 16. Внутренняя энергия (U): Абсолютное значение внутренней энергии измерить невозможно, поэтому измеряют ее приращение: ΔUсистемы = Uкон
- 17. Знак ΔU: (+) значения: система получила энергию; (-) значения: система потеряла энергию. 2H2O(г) → 2H2(г) +
- 18. Знак ΔU: (+) значения: система получила энергию; (-) значения: система потеряла энергию. 2H2O(г) → 2H2(г) +
- 19. Функции состояния системы ΔU=Q V , где Q V - теплота изохорного процесса. ΔU - кДж/моль
- 20. Единицы измерения энергии: Джоуль = Дж Так как Дж очень маленькая величина, обычно используют кДж. калория
- 21. Калория – это количество теплоты, необходимое для нагревания 1 г воды на 1oC (от 14.5 to
- 22. Первый закон термодинамики Первый закон термодинамики является постулатом: он не может быть доказан логическим путем, а
- 23. Первый закон термодинамики Химические процессы сопровождаются изменением энергии.
- 24. Первый закон термодинамики Является количественным выражением всеобщего закона природы о вечности материи и движения: энергия в
- 25. Вечный двигатель первого рода невозможен (работа требует энергии). Первый закон термодинамики
- 26. Система получает теплоту за счет работы внешних сил. Система теряет теплоту за счет совершение ею работы
- 27. Q w>0 Q>0 w U Как изменяется внутренняя энергия системы?
- 28. На что расходуется теплота, подведенная к системе?
- 29. Первый закон термодинамики Пример: Первая ситуация: идеальный газ находится в изолированном цилиндре с поршнем.
- 30. Первый закон термодинамики Что произойдет с газом, если поршень будет перемещаться?
- 31. Первый закон термодинамики Если цилиндр изолирован, температура будет расти, атомы будут двигаться быстрее, а давление повышаться.
- 32. Первый закон термодинамики Δx При этом внешние силы совершат работу в продвижении поршня: W = PΔV
- 33. Первый закон термодинамики Δx Работа, проделанная над газом, равна изменению внутренней энергии газа: W = ΔU
- 34. Первый закон термодинамики Вторая ситуация: цилиндр помещен на горячую плиту. Что произойдет с газом?
- 35. Первый закон термодинамики Атомы будут двигаться быстрее, в системе будет увеличиваться внутренняя энергия: Q = ΔU
- 36. Первый закон термодинамики F Что произойдет, если к системе одновременно подвести теплоту и продвинуть поршень?
- 37. Первый закон термодинамики F Подведенная теплота будет расходоваться на увеличение внутренней энергии и на совершение системой
- 38. Первый закон термодинамики Теплота, подведенная к системе, расходуется только на увеличение внутренней энергии системы и на
- 39. Теплота и работа: приращение внутренней работы ± Q = ΔU ± W Работа, совершаемая системой (+)
- 40. В биологических системах теплота обычно отдается системой во внешнюю среду, а работа совершается за счет убыли
- 41. Первый закон термодинамики Теплота (Q) - форма передачи энергии, посредством хаотического столкновения частиц соприкасающихся систем, системы
- 42. Первый закон термодинамики Работа (W) - форма передачи энергии от системы в окружающую среду или другой
- 43. Падающий груз поворачивает лопасти вертушки в изолированном стакане воды. Температура воды возрастает из-за механической работы внутри
- 44. Пар, идущий из чайника, заставляет вертушку крутиться в обычной паровой турбине. Работа, совершаемая паром, поднимает небольшой
- 45. Теплота расширения в изобарном процессе: W= p·ΔV, где ΔV - изменение объема системы, ΔV=V2-V1 Энтальпия (от
- 46. Энтальпия HCl раствор HCl раствор H 2 (г)
- 47. Функции состояния системы Из первого закона ТД: Q = ΔU + W Qр = ΔU +
- 48. Функции состояния системы Т.к. ΔН=Qр, => ΔН = ΔU + р·ΔV [кДж·моль-1] Энтальпию часто называют «тепловой
- 49. Эндотермический процесс, ΔН>0 Экзотермический процесс, ΔН Функции состояния системы
- 50. Энтальпия (H): Абсолютное значение энтальпии измерить невозможно, поэтому измеряют ее приращение: ΔHсистемы = Hкон - Hнач
- 51. Энтропия (S) характеризует связанную энергию. В реальных необратимых системах только часть энергии превращается в работу, другая
- 52. Функции состояния системы ΔS=Qmin/T, [Дж · моль-1 · К-1]. Энтропия (по Клаузиусу) - функция состояния системы,
- 53. Функции состояния системы Энтропия связана с вероятностью состояния системы уравнением Больцмана: S=КБ · InW, где KБ-постоянная
- 54. Чем выше энтропия, тем больше неупорядоченность системы.
- 55. Энтропия Sкристалла Sжидкости Sгаз Твердое тело Жидкость Газ
- 56. Энтропия Энтропия, S Твердое тело Жидкость Газ Плавление Кипение Температура, К
- 57. Функции состояния системы Ростом энтропии ΔS>0 сопровождаются такие самопроизвольные процессы, как испарение жидкости, таяние льда, растворение
- 58. Как бы Вы описали объект, у которого S=0? 0 K Абсолютно твердый кристалл без движения Чисто
- 59. “Мама, это не моя вина… Это Вселенная хочет, чтобы моя комната выглядела так!” Энтропия Вселенной всегда
- 60. Для изолированных систем является самопроизвольного протекания процессов: Самопроизвольный процесс Обратный процесс Состояние равновесия ΔS>0 ΔS ΔS=0
- 61. Приращение энтропии: 1.) Ag+(р-р)+ Cl-(р-р)→AgCl(к) 2.) NH4Cl(к)→ NH3(г)+ HCl(г) 3.) H2(г) + Br2(г)→2HBr(г) 1)ΔS 2)ΔS >
- 62. 4. Свободная энергия Гельмгольца ΔF = ΔU - TΔS Свободная энергия Гельмгольца -термодинамический потенциал, убыль которого
- 63. Функции состояния системы При протекании изобарно-изотермических процессов: 5. Свободная энергия Гиббса (G) Энергия Гиббса (G) -
- 64. Функции состояния системы Анализ уравнения: 1 Энтальпийный фактор ΔH. Определяет стремление системы снизить свою энергию за
- 65. Функции состояния системы Величина ΔG служит критерием возможности самопроизвольного протекания процессов. Процесс протекает самопроизвольно, если ΔG
- 66. Влияние температуры на величину ΔG: 1. При ΔН>0 , ΔS>0 , процесс протекает самопроизвольно только при
- 67. Функции состояния системы μ=G(x)/n(x), отсюда G(х)=n(х)·μ(х). Если система состоит из нескольких веществ x1, x2, x3…, то:
- 68. Функции состояния системы Для вещества, находящегося в растворе, μ зависит от концентрации раствора, и природы растворителя.
- 69. Вопросы для самоконтроля Что Вы понимаете под термодинамической системой? Охарактеризуйте термодинамические функции состояния (внутренняя энергия, энтальпия,
- 70. Раздел ТД, изучающий изменение энергии при протекании химических процессов, называется химической термодинамикой или термохимией. Термохимия
- 71. Основные понятия термохимии Химическая реакция как термодинамический процесс, заключается в превращении одних веществ в другие за
- 72. Основные понятия термохимии Термохимическое уравнение - условное изображение физико-химического процесса.
- 73. Особенности термохимических уравнений: 1. Уравнения записываются с учетом ТД функций состояния системы (ΔH, Δ S). 2.
- 74. 1. Основные понятия термохимии Тепловой эффект (Q, кДж·моль-1 ) - энергия, которая выделяется или поглощается в
- 75. Основные понятия термохимии Стандартный тепловой эффект - теплота физико-химического процесса, протекающего в стандартных условиях: Т=298К, р=101,3
- 76. Частным выражением 1-го начала термодинамики применительно к химическим процессам является закон Гесса (1840 г): Приращение энтальпии
- 77. Приращение энтальпии (ΔH) ΔH = H2 – H1 Энтальпия является функцией состояния. A B С Приращение
- 78. Закон Гесса Например: Если С (т) + О2 (г) = СО2 (г), ΔН1; или провести процесс
- 79. Приращение энтальпии (ΔH) В реакции: ΔH = Hпродукты - Hреагенты ΔH > 0 - теплота поглощается,
- 80. Энергия выделяется ⇒ Экзотермическая реакция Реагенты Продукты Экзотермический процесс ΔH теплота выделяется. Энтальпия, кДж
- 81. Энергия поглощается ⇒ Эндотермическая реакция Продукты Реагенты Эндотермический процесс ΔH > 0 - теплота поглощается Энтальпия,
- 82. Закон Гесса: Из первого закона термодинамики: ΔUсистема = -ΔUсреда Каждому экзотермическому процессу соответствует эндотермический процесс.
- 83. Задача: Реакция происходит в присутствии катализатора MnO2: 2KClO3(к) → 2KCl(к) + 3O2(г) ΔH = -89.7 кДж
- 84. Определите знак теплового эффекта процесса: Плавление льда? Кристаллизация воды ? Горение свечи? Взрыв динамита?
- 85. Закон Гесса Расчеты тепловых эффектов реакций (ΔН0х.р.) по термохимическим уравнениям производят либо по теплотам образования веществ,
- 86. Калори́метр (от лат. calor - тепло и metor - измерять) прибор для измерения количества теплоты, выделяющейся
- 87. Закон Гесса Энтальпия образования вещества (теплота образования) – это тепловой эффект реакции образования 1 моля вещества
- 88. Закон Гесса Энтальпия образования, измеренная при стандартных условиях, называется стандартной энтальпией образования и является справочной величиной,
- 89. Первое следствие закона Гесса ΔН0проц. = ∑nΔН0обр(прод) - ∑nΔН0обр(реагент), ΔН0проц.[кДж ·моль-1]. Тепловой эффект процесса равен алгебраической
- 90. CS2(к) + 3O2(г) → CO2(г) + 2SO2(г) ΔН0обр: 87.9кДж/моль 0 кДж/моль -393.5 кДж/моль -296.8 кДж/моль Каждое
- 91. CS2(к) + 3O2(г) → CO2(г) + 2SO2(г) ΔН0обр: 87.9кДж/моль 0 кДж/моль -393.5 кДж/моль -296.8 кДж/моль ΔН0проц.=
- 92. Закон Гесса Для многих органических соединений невозможно одновременно синтезировать сложное вещество из простых и при этом
- 93. Закон Гесса Энтальпия сгорания (теплота сгорания) – тепловой эффект реакции сгорания 1 моля вещества до высших
- 94. Закон Гесса Энтальпия сгорания, измеренная при стандартных условиях, называется стандартной, обозначается ΔН0сгор.(Х) [кДж · моль-1]. Энтальпии
- 95. ΔН0проц. = ∑nΔН0сгор(реаг.) -∑nΔН0сгор(прод.), [кДж · моль-1] Второе следствие закона Гесса: Тепловой эффект химического процесса равен
- 96. Второй закон термодинамики устанавливает направление протекания самопроизвольных процессов. Второе начало термодинамики
- 97. Второе начало термодинамики Существуют различные равнозначные по смыслу формулировки 2-го начала термодинамики. М.В. Ломоносов (1850), Р.
- 98. Второе начало термодинамики
- 99. Второе начало термодинамики 200° 100°
- 100. Второе начало термодинамики 200° 100°
- 101. Второе начало термодинамики 200° 100°
- 102. Второе начало термодинамики 150°
- 103. Второе начало термодинамики 150°
- 104. У. Кельвин (1854): Никакая тепловая машина не может полностью превратить тепло в работу: часть его обязательно
- 105. Второе начало термодинамики В. Освальд (1888): Невозможен вечный двигатель второго рода, т.е. невозможно полное превращение теплоты
- 106. Второе начало термодинамики Паровой двигатель
- 107. Второе начало термодинамики Больцман: самопроизвольно могут протекать только такие процессы, при которых система из менее вероятного
- 108. Второе начало термодинамики Для изолированной системы (при Е=const, V= const) критерием самопроизвольности процесса является энтропия (S).
- 109. Самопроизвольные процессы Пример Свободное перемещение газа Вентиль закрыт Вакуум Газ
- 110. Самопроизвольные процессы Пример Свободное перемещение газа Вентиль открыт Газ Увеличение энтропии Равновесие Газ
- 111. Второе начало термодинамики Современная формулировка: энергия любого вида может переходить от одного тела к другому только
- 112. Второе начало термодинамики Для процессов, протекающих при р=соnst и Т=соnst, роль термодинамического потенциала выполняет энергия Гиббса
- 113. Второе начало термодинамики В условиях постоянной температуры и давления самопроизвольно могут протекать только такие процессы, при
- 114. Второе начало термодинамики Математическое выражение 2-го начала термодинамики: ΔG0пр. = ∑nΔG0обр(прод) - ∑nΔG0обр(реагент), ΔG0пр.= ΔН0 –
- 115. Биоэнергетика Основным источником энергии для организма человека является химическая энергия, заключенная в пищевых продуктах, часть которой
- 116. Биоэнергетика Химическая энергия также расходуется на совершение внешней работы, связанной с перемещениями человека, его трудовой деятельностью
- 117. Вопросы для самоконтроля В чем состоят особенности термохимических уравнений? Сформулируйте закон Гесса и его следствия. Сформулируйте
- 118. Химическое равновесие
- 119. Равновесное состояние - такое состояние системы, когда при постоянных внешних условиях параметры системы не изменяются во
- 120. Химическое равновесие Истинное CO + H2O CO2 + H2 Метастабильное 2H2 + O2 = 2H2O
- 121. Термодинамика химического равновесия Состояние химического равновесия характеризуют законом действующих масс. Для обратимой химической реакции вида: aA
- 122. Закон действующих масс (гомогенные системы) aA + bB dD + eE c(A) = [A] = const
- 123. Термодинамика химического равновесия Константа химического равновесия зависит от природы реагирующих веществ и температуры и не зависит
- 124. Сдвиг химического равновесия Анри Луи Ле Шателье (1884): Любое воздействие на систему, находящуюся в состоянии химического
- 125. Влияние температуры Реакция эндотермическая – Q, ΔH > 0 при повышении температуры при понижении температуры Реакция
- 126. Принцип Ле Шателье CaCO3 CaO + CO2 – Q (ΔH > 0) при повышении температуры 2NO
- 127. Влияние концентрации Введение реагента Удаление реагента Введение продукта Удаление продукта Kc = const При V =
- 128. Принцип Ле Шателье 2SO2 + O2 2SO3 при увеличении концентрации О2
- 129. Влияние давления aA + bB dD + eE если d + e = a + b
- 130. Принцип Ле Шателье Δn(газ.) > 0 при повышении давления при понижении давления Δn(газ.) при повышении давления
- 131. Влияние давления N2 + 3H2 2NH3 Δn(газ.) = 2 – 4 при повышении давления
- 132. Принцип Ле Шателье Катализатор не влияет на Kc не является реагентом или продуктом => не смещает
- 133. Термодинамика химического равновесия Направление данной химической реакции общего вида: aA + bB cC + dD при
- 134. Термодинамика химического равновесия Пс – величина стехиометрического соотношения концентраций веществ, участвующих в реакции при заданных условиях:
- 136. Скачать презентацию
 Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Химические реакции в органической химии (10 класс)
Химические реакции в органической химии (10 класс) Жесткость воды. Способы ее устранения
Жесткость воды. Способы ее устранения Хімічні явища у природі
Хімічні явища у природі Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу
Төменгі фосфориттерден азот – фосфорлы тыңайтқыштар алу технологиясын әзірлеу Металлы. Классификация металлов
Металлы. Классификация металлов Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Алкены. Гомологический ряд и изомерия
Алкены. Гомологический ряд и изомерия 20231113_tipy_him._reaktsiy_prezentatsiya
20231113_tipy_him._reaktsiy_prezentatsiya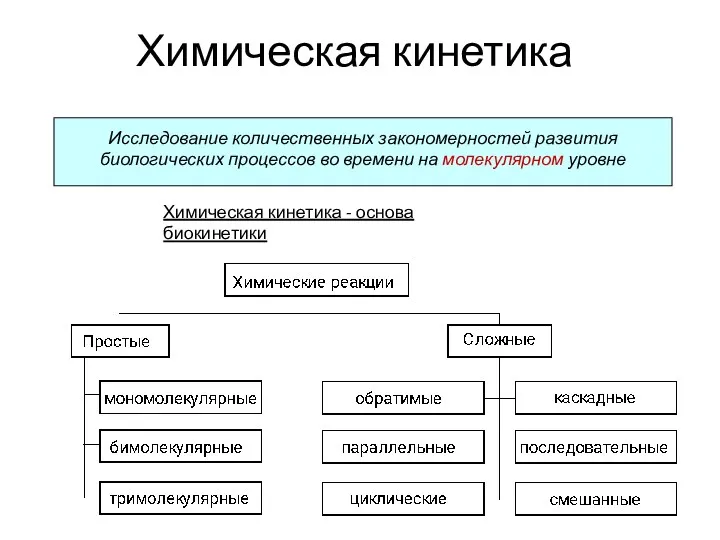 Химическая кинетика
Химическая кинетика Углерод и кремний
Углерод и кремний Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды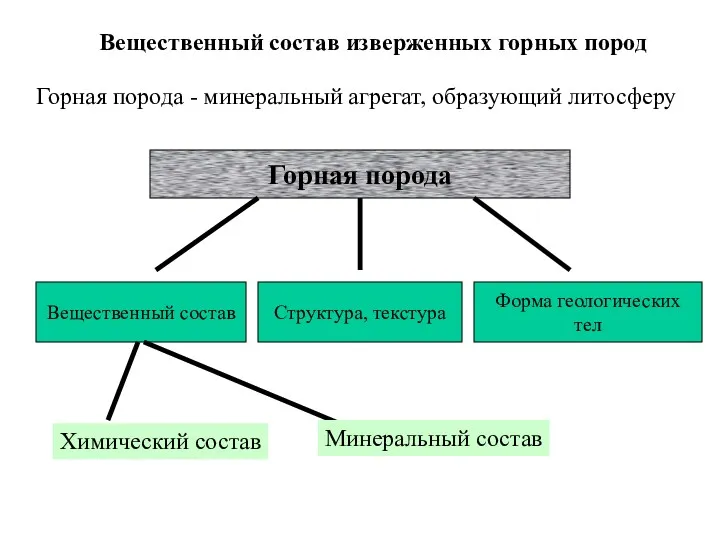 Вещественный состав изверженных горных пород
Вещественный состав изверженных горных пород Устойчивость дисперсных систем
Устойчивость дисперсных систем Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов Нуклеиновые кислоты
Нуклеиновые кислоты Окисление и восстановление
Окисление и восстановление Алкоголь
Алкоголь Степень окисления
Степень окисления Соли. Определение солей
Соли. Определение солей Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Естествознание для всех. Викторина
Естествознание для всех. Викторина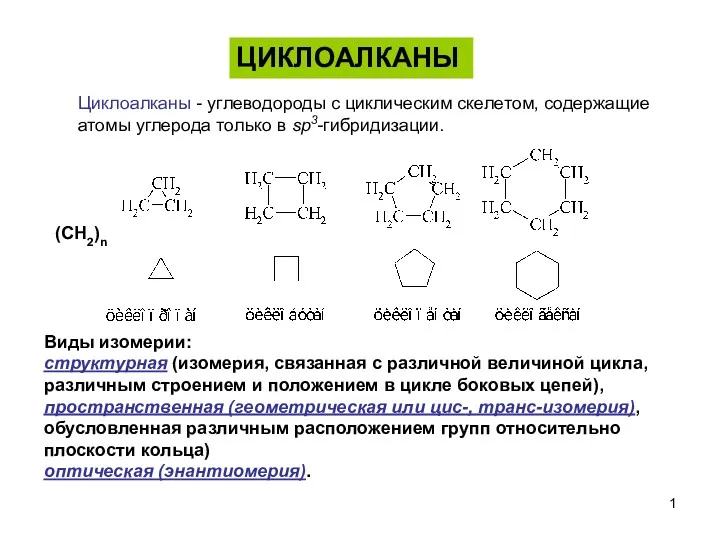 Циклоалканы
Циклоалканы Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Щелочные породы среднего состава
Щелочные породы среднего состава Степень окисления
Степень окисления Способы выражения концентрации растворов
Способы выражения концентрации растворов