Слайд 2

Цель урока:
Разобраться, что такое «степень окисления»
Научиться находить степень окисления по формуле
Слайд 3

Поваренная соль NaCl
«Хлеб да соль» - пожелание добра
«Надо вместе съесть
пуд соли, чтобы узнать человека»
За какое время это можно сделать?
Пуд – 16 кг
3,5 – 5,5 кг в год
Примерно 2 года
Слайд 4

Влияние Na на организм человека
Хранят простое вещество «натрий» как Кощееву смерть.
Как
может повлиять натрий на организм человека?
Слайд 5

Влияние Cl2 на организм человека
Хлор – отравляющее вещество, применявшееся во время
первой мировой войны
Слайд 6

Образование сложного вещества
Na0 +11 2е,8е,1е
Cl0 +17 2e,8e,7e
Какой вид связи может
образоваться между этими атомами?
Na0 + Cl0 → Na+ + Cl- → Na+Cl-
Слайд 7
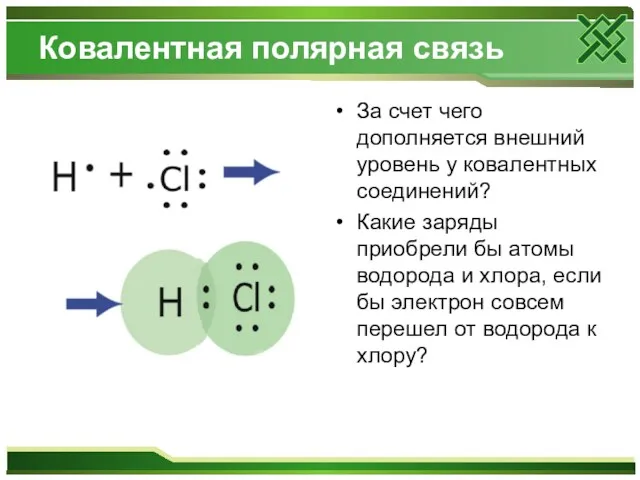
Ковалентная полярная связь
За счет чего дополняется внешний уровень у ковалентных соединений?
Какие заряды приобрели бы атомы водорода и хлора, если бы электрон совсем перешел от водорода к хлору?
Слайд 8
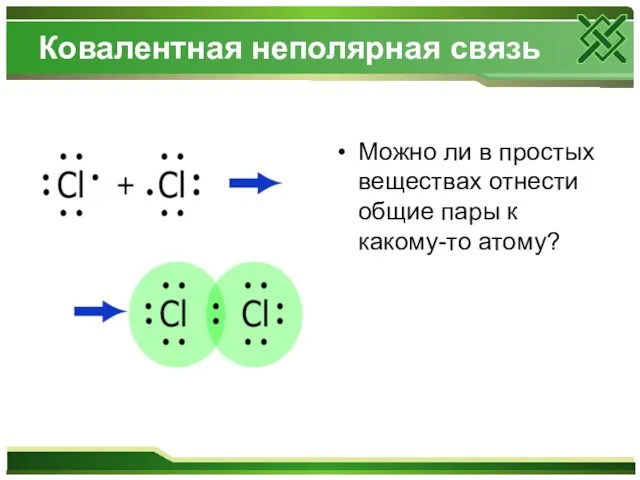
Ковалентная неполярная связь
Можно ли в простых веществах отнести общие пары к
какому-то атому?
Слайд 9
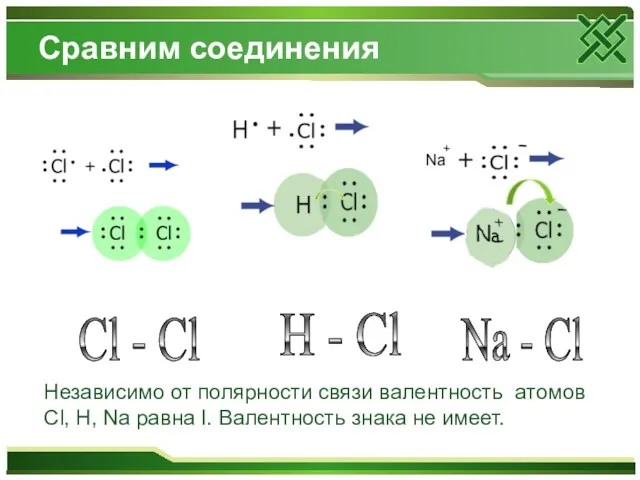
Сравним соединения
H - Cl
Cl - Cl
Na - Cl
Независимо
от полярности связи валентность атомов Cl, H, Na равна I. Валентность знака не имеет.
Слайд 10

Степень окисления –
это условный заряд атомов химических элементов в соединении,
вычисленный на основе предположения, что все соединения состоят из ионов
Слайд 11

Правила определения с.о.
Сумма С.О. атомов равна нулю
С.о. атомов в простых веществах
= 0
С.о. фтора = -1
С.о. кислорода = -2 (кроме Н2О2-1, O+2F2)
С.о. водорода = +1 (кроме МеН-1)
С.о.Ме I, II, III групп = номеру группы
С.о неМе «+» = номеру группы
С.о. неМе «-» = 8 – номер группы
Слайд 12

Возможные с.о.
Положительная «+» равна числу отданных электронов. Максимальная с.о. равна номеру
группы
Отрицательная «-» равна числу принятых электронов. Минимальная с.о. равна 8 – номер группы
Нулевое значение с.о. имеют атомы в молекулах с неполярной связью
Слайд 13

Промежуточные с.о.
Рассмотрим возможные с.о. серы – S
Максимальная +6 SO3
Минимальная -2 H2S
Сера
может проявлять с.о. 0,+2,+4 – это промежуточные с.о.
Слайд 14

Определение с.о.
N2O3
На первом месте стоит элемент с «+» с.о., на втором
с «-»
У кислорода постоянная с.о.=-2
У азота переменная с.о.
x -2
N2O3
Слайд 15

Задание 1
Определите С.О. по формулам
Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3,
Cu2O














 Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз Внесение минеральных удобрений
Внесение минеральных удобрений Общие сведения об электрорадиоматериалах
Общие сведения об электрорадиоматериалах Атомдар мен молекулалар
Атомдар мен молекулалар Методы нахождения коэффициентов в уравнениях химических реакций
Методы нахождения коэффициентов в уравнениях химических реакций Бытовая химия
Бытовая химия Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Химическая связь. Электроотрицательность и полярность связи
Химическая связь. Электроотрицательность и полярность связи Электрохимический ряд напряжения металлов
Электрохимический ряд напряжения металлов Оксиды. 9 класс
Оксиды. 9 класс Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Гидроочистка нефти и газа
Гидроочистка нефти и газа Мир кристаллов
Мир кристаллов Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства История и методология химии. Лекция 8
История и методология химии. Лекция 8 Кремний и его соединения
Кремний и его соединения s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи
s-елементи ІІ А групи: Берилій, Магній і лужноземельні елементи. Властивості елементів ІІ А групи Основные свойства и механизмы упрочнения КМ
Основные свойства и механизмы упрочнения КМ Растворы. Способы выражения концентрации раствора
Растворы. Способы выражения концентрации раствора Урок 25
Урок 25 Химический состав клетки
Химический состав клетки Методы хроматографии. Ионообменная хроматография
Методы хроматографии. Ионообменная хроматография Волшебные кристалы
Волшебные кристалы Полимеры, их классификации и способы получения
Полимеры, их классификации и способы получения СОЕДИНЕНИЯ ХРОМА
СОЕДИНЕНИЯ ХРОМА Единство химической организации живых организмов
Единство химической организации живых организмов Химия в продуктах питания
Химия в продуктах питания Органічні сполуки (9 клас)
Органічні сполуки (9 клас)