Содержание
- 2. Положение металлов в ПСХЭ- все d,f-элементы, s-все, кроме первого периода и р-слева от диагонали В-At Особенности
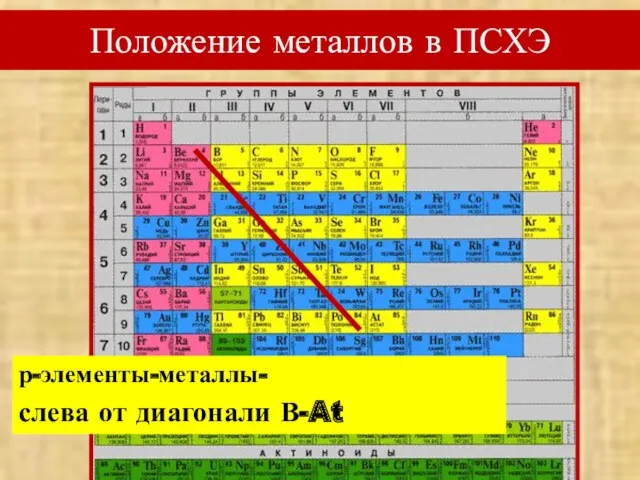
- 3. Положение металлов в ПСХЭ р-элементы-металлы- слева от диагонали В-At
- 4. Атомы металлов – ……………. электроны с внешнего энергетического уровня, поэтому являются ……………………….. отдают восстановителями
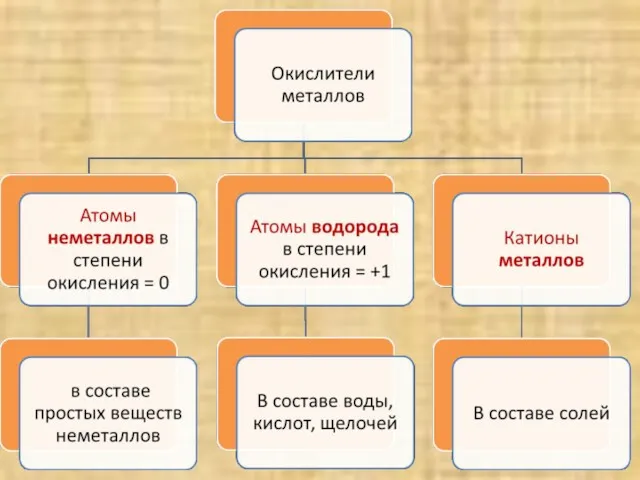
- 5. Атомы металлов – восстановители, а катионы металлов? Катионы металлов принимают электроны, и являются окислителями
- 7. Металлы взаимодействуют С неметаллами с образованием бинарных соединений (оксидов, гидридов, сульфидов, галогенидов и др.) С водой
- 8. Примеры (закончите): С неметаллами с образованием бинарных соединений (оксидов, гидридов, сульфидов, галогенидов и др. Fe +
- 9. Примеры: С растворами кислот с образованием солей и выделением водорода Zn + HCl С растворами солей
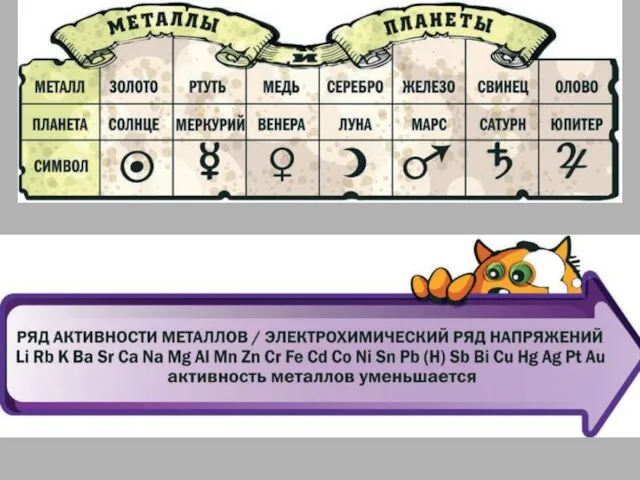
- 10. Электрохимический ряд напряжений металлов.
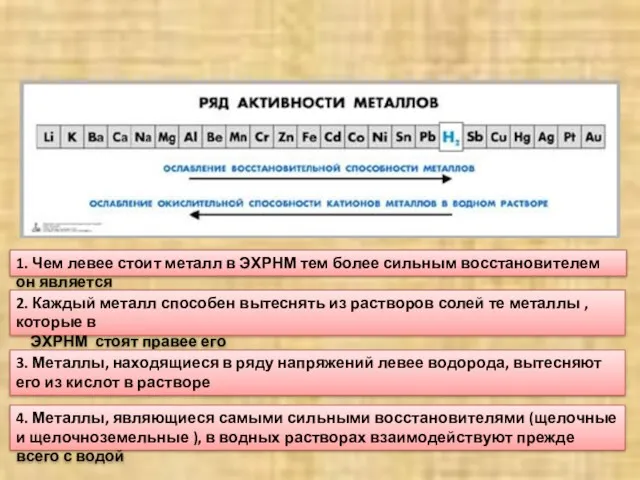
- 12. 1. Чем левее стоит металл в ЭХРНМ тем более сильным восстановителем он является 2. Каждый металл
- 13. Металлы после водорода… Взаимодействие с концентрированной серной кислотой при нагревании Cu + 2H2SO4 = CuSO4 +
- 14. Металлы после водорода… Взаимодействие с концентрированной и разбавленной азотной кислотой. Cu + 4HNO3 = Cu(NO3)2 +
- 15. Металлы после водорода… 3. Взаимодействие золота с «царской водкой» Au + HNO3 + 4HCl = H[AuCl4]
- 16. Итак: Металл + кислород = оксид металла Металл + хлор = хлорид металла Металл + сера
- 17. Металл + серная кислота (к) = соль + вода + «Х», где «Х» - SO2, S,
- 18. Напишите реакции: калий + вода = кальций + вода = металлы, стоящие в ЭХРНМ до водорода,
- 19. железо + соляная кислота = никель + серная кислота разб.= металлы, стоящие в ЭХРНМ до водорода,
- 20. железо + сульфат меди (II) = медь + нитрат ртути (II) = металлы взаимодействуют с растворами
- 21. Напишите реакции взаимодействия магния с кислородом, хлором, азотом, водой, соляной кислотой, хлоридом меди(II) Напишите реакцию взаимодействия
- 23. Скачать презентацию
















 Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Химическая организация клетки. Неорганические вещества, входящие в состав клетки
Химическая организация клетки. Неорганические вещества, входящие в состав клетки Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Структура реального кристалла
Структура реального кристалла Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Чистые вещества и смеси
Чистые вещества и смеси Азотжәне Фосфорэлементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар
Азотжәне Фосфорэлементтерін салыстырыңдар,мәліметтерді кестеге толтырыңдар Дослідження оптичних властивостей нематичних рідких кристалів допованих Оксидом церію IV (СеО2)
Дослідження оптичних властивостей нематичних рідких кристалів допованих Оксидом церію IV (СеО2)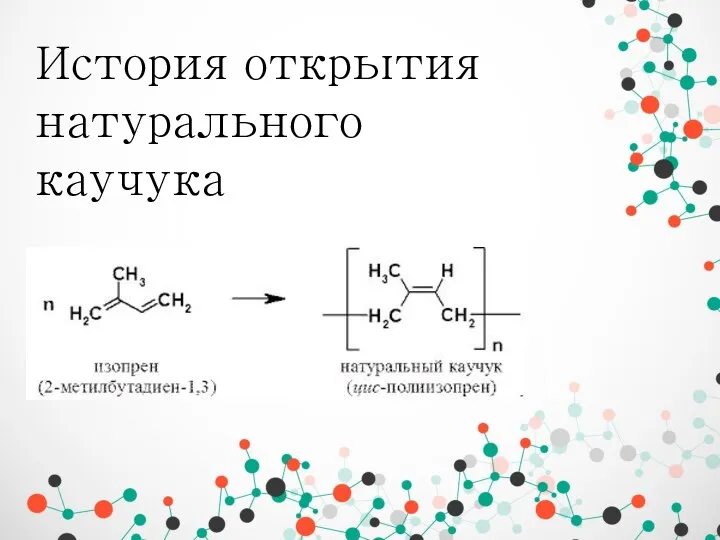 История открытия натурального каучука
История открытия натурального каучука Устойчивость дисперсных систем
Устойчивость дисперсных систем Cкорость химической реакции
Cкорость химической реакции Степень окисления
Степень окисления Выделение ферментных препаратов методами осаждения и высаливания
Выделение ферментных препаратов методами осаждения и высаливания Хімічний зв'язок і будова речовини
Хімічний зв'язок і будова речовини Химическая связь
Химическая связь Формирование ключевых компетенций на уроках химии
Формирование ключевых компетенций на уроках химии Галогены в Периодической системе Д.И. Менделеева
Галогены в Периодической системе Д.И. Менделеева Минералогия. Формы нахождения минералов в природе. Свойства минералов
Минералогия. Формы нахождения минералов в природе. Свойства минералов Аллотропия
Аллотропия Пниктогены элеметны VA группы
Пниктогены элеметны VA группы Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation
Svante Arrhenius and the theory of electrolytic and non-electrolytic dissociation Проведення полімеразної ланцюгової реакції з використанням діагностичних тест-систем
Проведення полімеразної ланцюгової реакції з використанням діагностичних тест-систем Степень окисления. Подготовка к контрольной работе
Степень окисления. Подготовка к контрольной работе Углекислый газ
Углекислый газ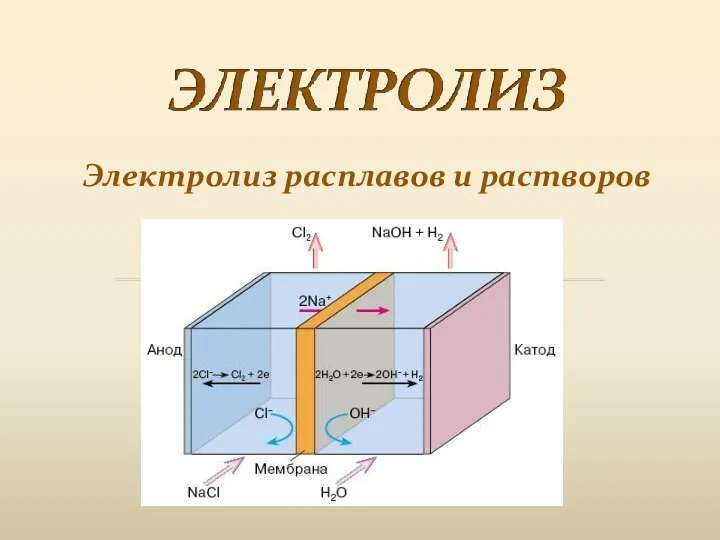 Электролиз расплавов и растворов
Электролиз расплавов и растворов Пластмассы
Пластмассы Основания. 8 класс
Основания. 8 класс