Содержание
- 2. Цели: Охарактеризовать положение галогенов в Периодической системе Д.И.Менделеева. Охарактеризовать особенности строения атомов галогенов. Охарактеризовать физические свойства.
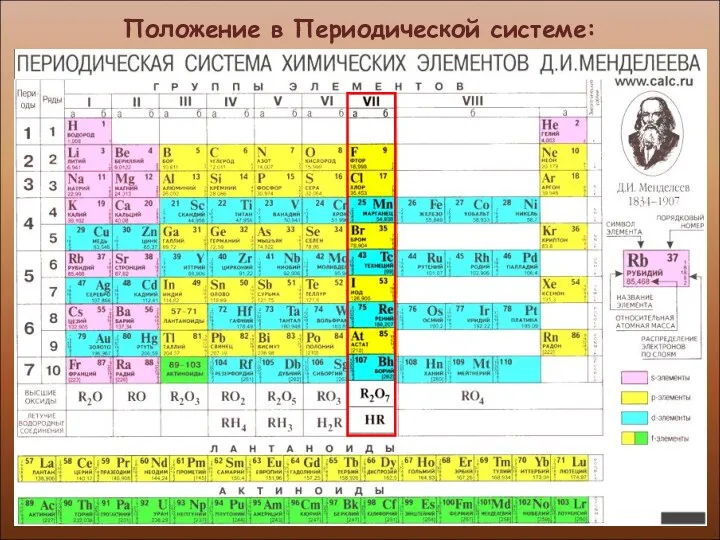
- 3. Положение в Периодической системе:
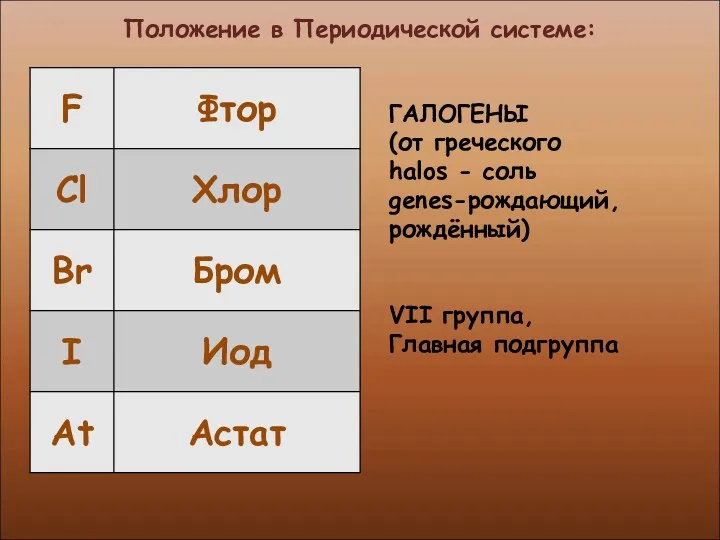
- 4. Положение в Периодической системе: ГАЛОГЕНЫ (от греческого halos - соль genes-рождающий, рождённый) VII группа, Главная подгруппа
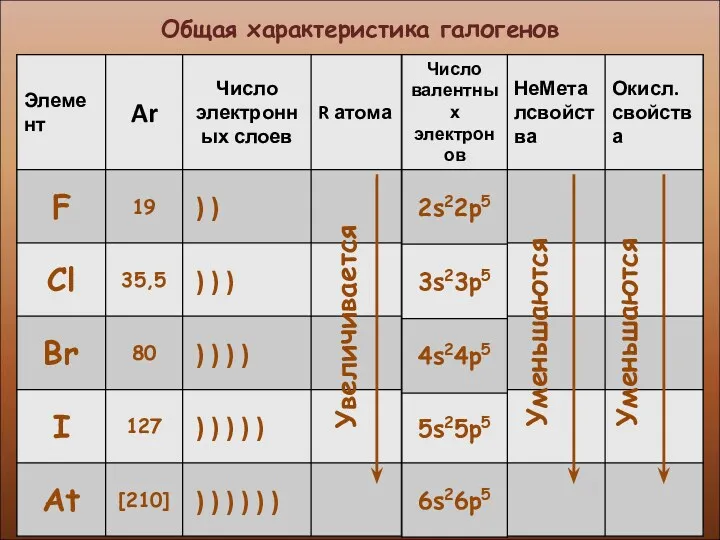
- 5. Общая характеристика галогенов
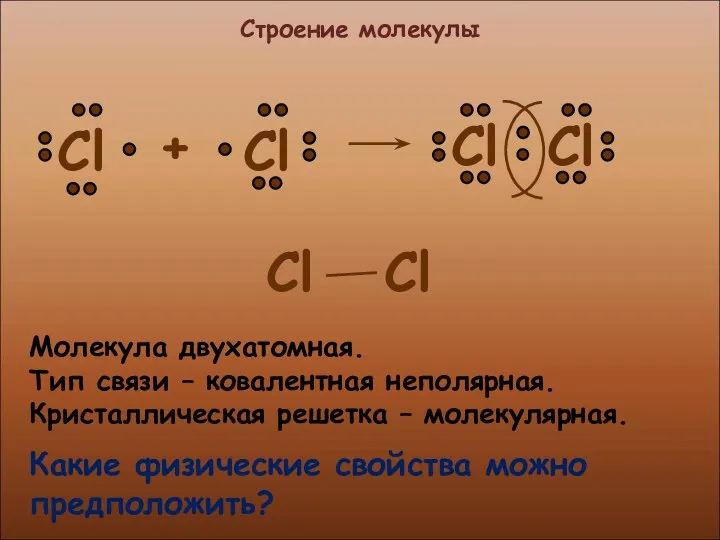
- 6. Строение молекулы Молекула двухатомная. Тип связи – ковалентная неполярная. Кристаллическая решетка – молекулярная. Какие физические свойства
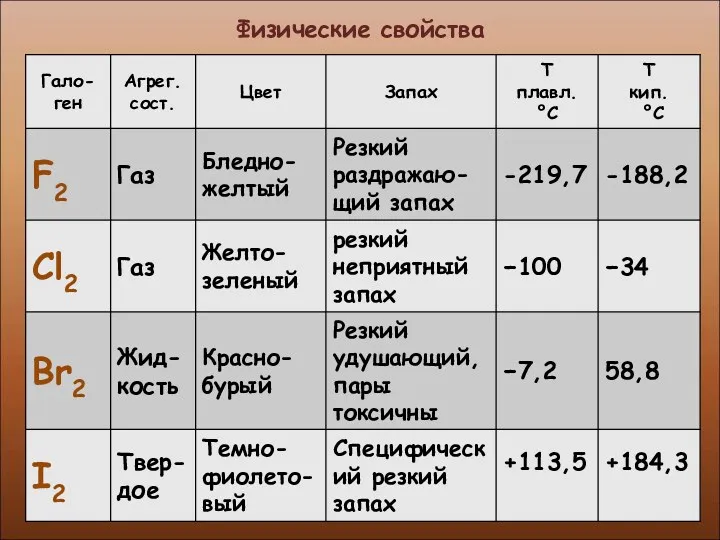
- 7. Физические свойства
- 8. Физические свойства
- 9. Физические свойства
- 10. Физические свойства
- 11. Физические свойства
- 12. Физические свойства
- 13. Физические свойства Этот элемент был вторым (после технеция) синтезированным искусственно элементом. Все изотопы астата короткоживущие, очень
- 14. Возгонка йода Кристаллический йод обладает способностью при нагревании переходить из твердого состояния в газообразное, минуя жидкое
- 15. Нахождение в природе CaF2 Флюорит (плавиковый шпат)
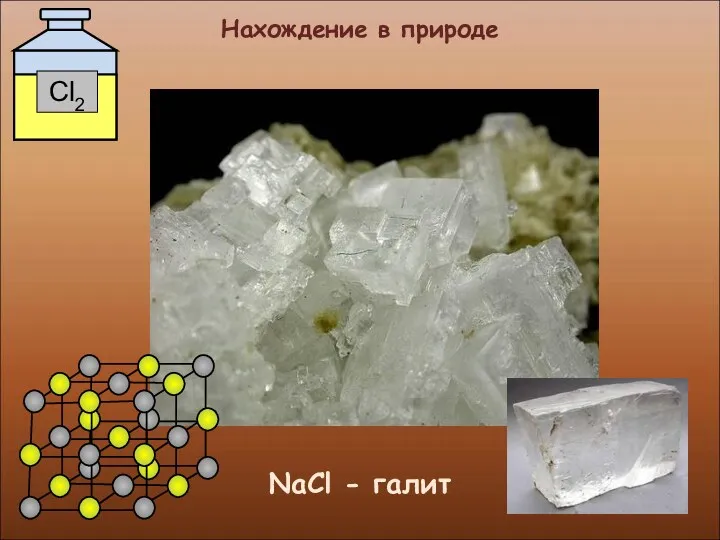
- 16. Нахождение в природе NaCl - галит
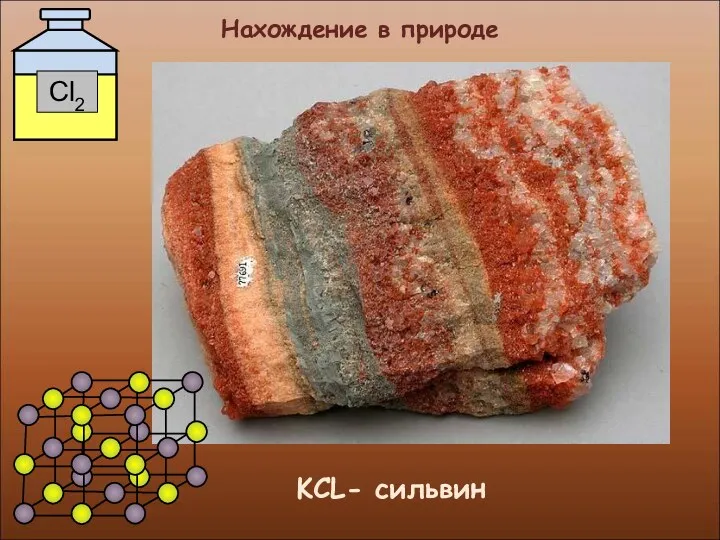
- 17. Нахождение в природе KCL- сильвин
- 18. Нахождение в природе Бром и иод добывают из природных вод. Источник иода – морские водоросли –
- 19. Химические свойства
- 20. Химические свойства. При взаимодействии галогенов с металлами образуются соли – галогениды. Zn + F2 = ZnF2
- 21. Химические свойства При взаимодействии галогенов с водородом образуются галогеноводороды (при растворении в воде галогеноводороды образуют кислоты)
- 22. Химические свойства Cl2, Br2, I2 взаимодействуют по схеме: Гal2 + H2O = HГalО + НГal Cl2
- 23. Химические свойства Более активный галоген вытесняет менее активный из растворов солей. F2 > Cl2 > Br2
- 24. Химические свойства фтора Взаимодействует со всеми металлами с выделением большого количества теплоты: с алюминием: 3F2 +
- 25. Химические свойства фтора Реагирует при облучении даже с инертными газами Xe + F2 → Xe F2
- 26. Химические свойства брома Химическая активность брома меньше, чем у фтора и хлора, но достаточно высока. С
- 27. Химические свойства йода Химическая активность йода еще ниже, чем у брома. С металлами только при нагревании:
- 28. Вывод: химическая активность галогенов уменьшается от фтора к йоду, поэтому галоген с меньшим порядковым номером может
- 29. Качественные реакции на галогенид-ионы Качественные реакции на хлориды, бромиды и йодиды -образование нерастворимых галогенидов серебра: NaCl
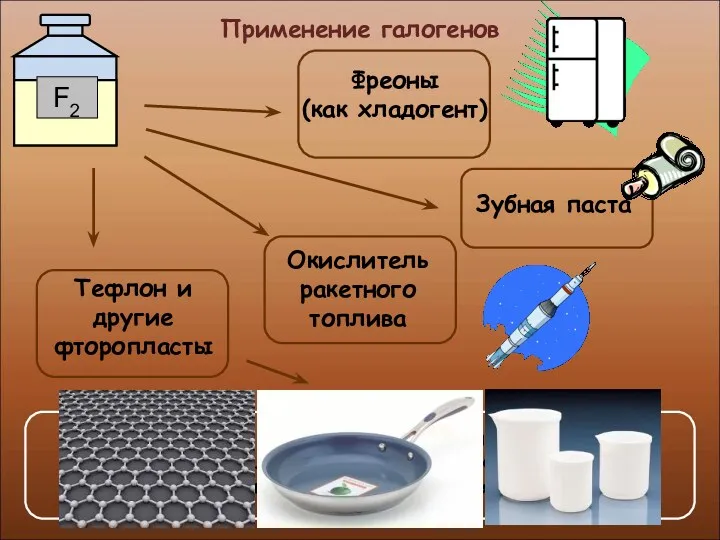
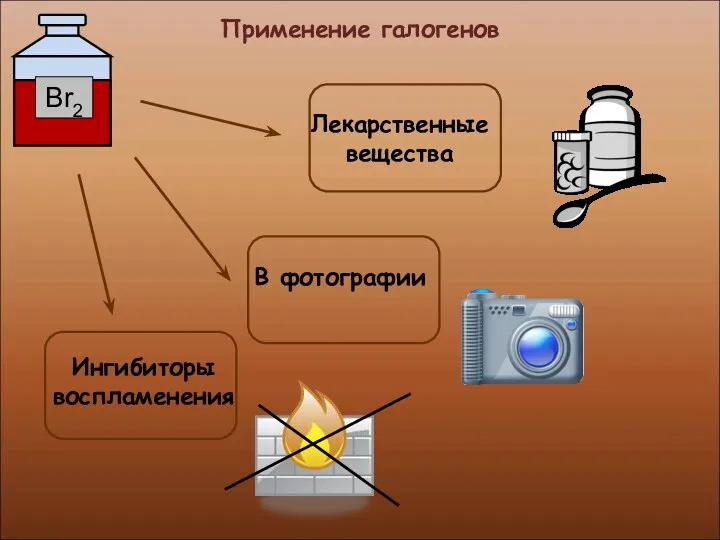
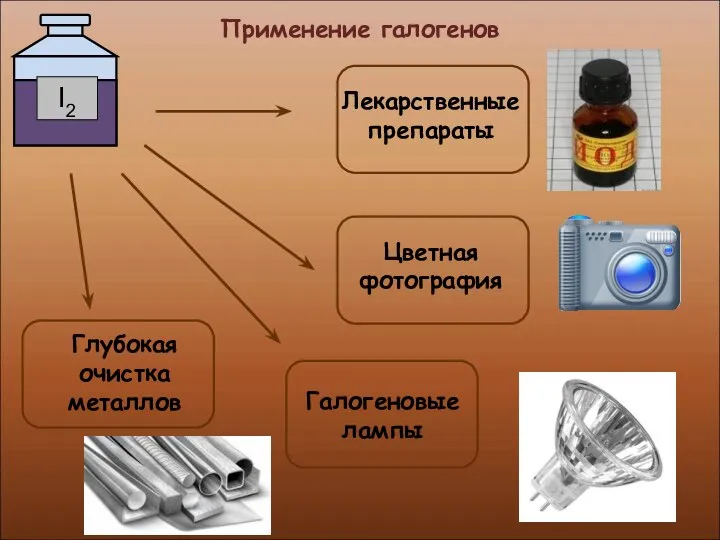
- 30. Применение галогенов
- 31. Применение галогенов Производство медикаментов, красок и пластмасс Производство соляной кислоты и хлоридов
- 32. Применение галогенов
- 33. Применение галогенов
- 34. Галогены в организме человека Фтор находится в организме во всех органах и тканях. Но наибольшее его
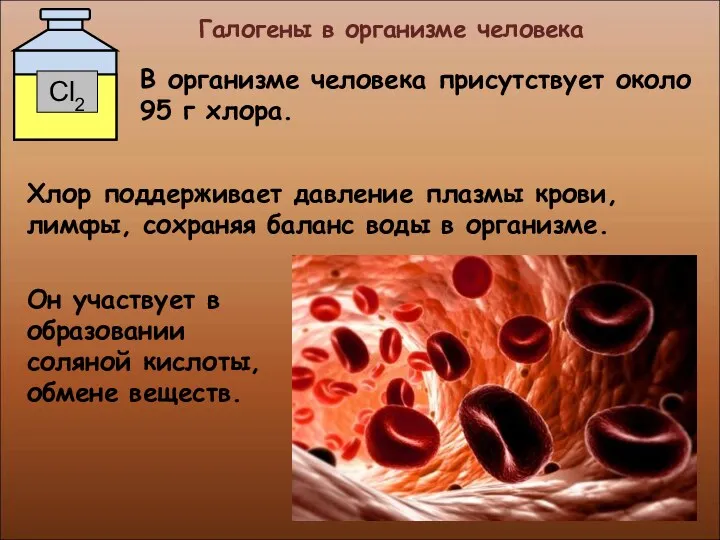
- 35. Галогены в организме человека Он участвует в образовании соляной кислоты, обмене веществ. В организме человека присутствует
- 36. Галогены в организме человека Содержание брома в организме человека (масса тела 70 кг) составляет 260 мг.
- 38. Скачать презентацию
























 Основные понятия и законы химии. Тема1
Основные понятия и законы химии. Тема1 Методы определения физико-химических условий минерало-и рудообразования
Методы определения физико-химических условий минерало-и рудообразования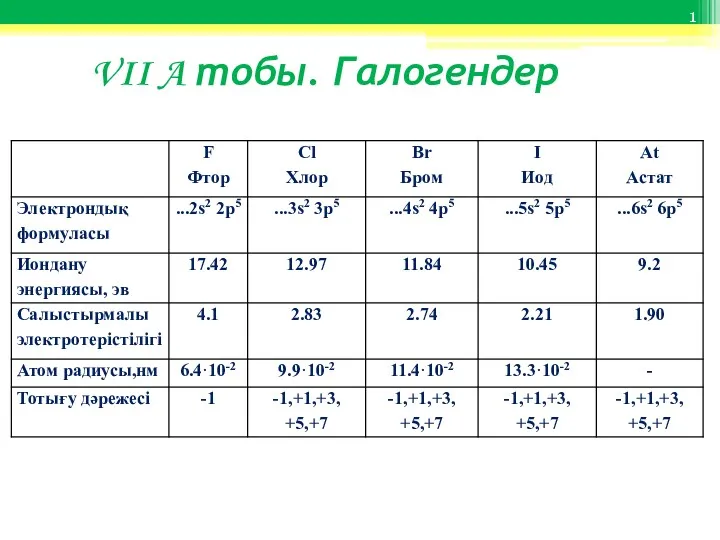 VII A тобы. Галогендер
VII A тобы. Галогендер Соединения железа Fe+2 и Fe+3
Соединения железа Fe+2 и Fe+3 Феноли (бензенол)
Феноли (бензенол) Характеристика химических элементов и химических реакций
Характеристика химических элементов и химических реакций Минерал лазурит. Месторождения
Минерал лазурит. Месторождения Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы
Тема 1. Обработка вооружения, техники и обмундирования. Дегазирующие, дезактивирующие и дезинфицирующие вещества и растворы Чисті речовини та суміші. (7 клас)
Чисті речовини та суміші. (7 клас) Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Предмет аналитической химии и ее основные понятия
Предмет аналитической химии и ее основные понятия Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Азотная кислота. Получение, свойства. Нитраты, азотные удобрения
Азотная кислота. Получение, свойства. Нитраты, азотные удобрения Химические реакции
Химические реакции Откуда берутся кристаллы
Откуда берутся кристаллы Одноатомные спирты
Одноатомные спирты Фазовые диаграммы и статистическая термодинамика бинарных m-h систем
Фазовые диаграммы и статистическая термодинамика бинарных m-h систем Молекулярная кулинария
Молекулярная кулинария Углеводы. Моносахариды. Лекция 5
Углеводы. Моносахариды. Лекция 5 Закон постоянства состава вещества
Закон постоянства состава вещества Химическая промышленность и химическая технология
Химическая промышленность и химическая технология Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів
Окисно-відновні реакції, їхнє значення. Складання найпростіших окисно-відновних реакцій, добір коефіцієнтів Вода: фізичні та хімічні властивості. Поширеність в природі
Вода: фізичні та хімічні властивості. Поширеність в природі Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Аллотропные модификации кремния
Аллотропные модификации кремния Периодический закон и свойства химических элементов
Периодический закон и свойства химических элементов Химическая связь
Химическая связь