Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева презентация
Содержание
- 2. ПОРЯДКОВЫЙ НОМЕР ЭЛЕМЕНТА ПОКАЗЫВАЕТ ЧИСЛО ПРОТОНОВ (ЗАРЯД ЯДРА), ЧИСЛО ЭЛЕКТРОНОВ В ЭЛЕКТРОННОЙ ОБОЛОЧКЕ АТОМА. Номер периодов
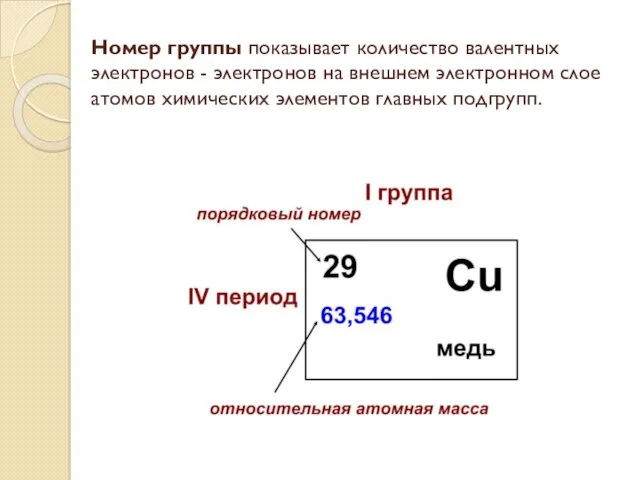
- 3. Номер группы показывает количество валентных электронов - электронов на внешнем электронном слое атомов химических элементов главных
- 4. O – кислород, порядковый номер элемента – 8, относительная атомная масса 15,9994, номер группы- VI, второй
- 5. Закономерности изменения свойств химических элементов и их соединений по периодам и группам Химические свойства элементов (а
- 6. Не надо учить наизусть химические свойства каждого атома… ответ на любой вопрос находится в Периодической системе
- 7. Изменения свойств химических элементов и их соединений в группах: В группах все элементы имеют сходное электронное
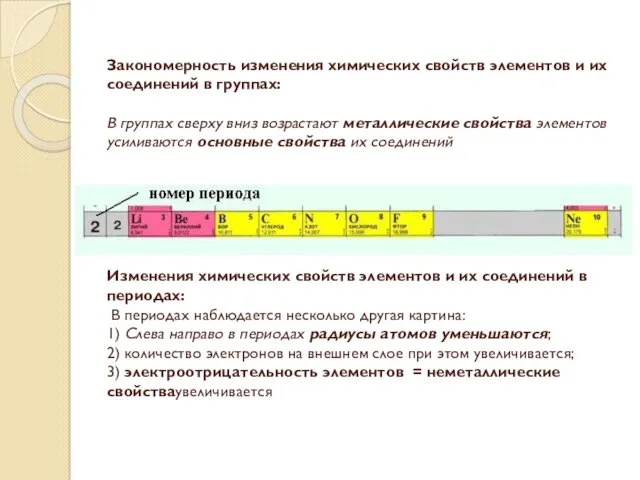
- 8. Закономерность изменения химических свойств элементов и их соединений в группах: В группах сверху вниз возрастают металлические
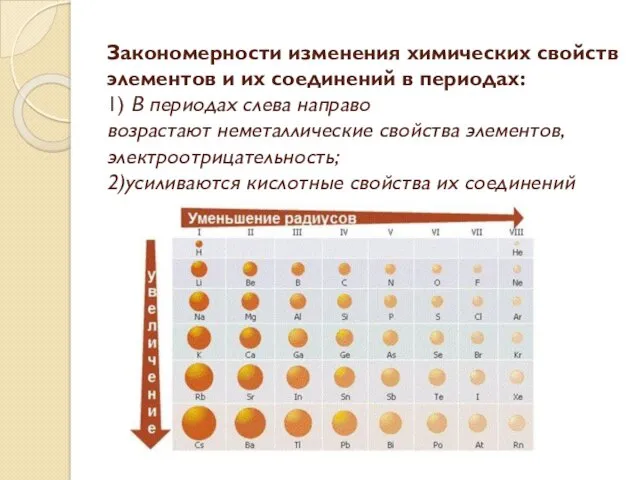
- 9. Закономерности изменения химических свойств элементов и их соединений в периодах: 1) В периодах слева направо возрастают
- 10. Есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические
- 11. Подведем итог: С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений
- 13. Скачать презентацию






 Синтетические моющие средства
Синтетические моющие средства Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Основные виды химических связей
Основные виды химических связей Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения
Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения Акарицидтер. Тетразиндер. Бензи-латтар. Сульфоқышқыл туындылары. Хина-золиндер . Пирозолдар. Пиридазипондар
Акарицидтер. Тетразиндер. Бензи-латтар. Сульфоқышқыл туындылары. Хина-золиндер . Пирозолдар. Пиридазипондар Кристаллические решетки
Кристаллические решетки Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Химия пәні. Заттар және олардың қасиеттері
Химия пәні. Заттар және олардың қасиеттері Наноалмазы детонационного синтеза
Наноалмазы детонационного синтеза Амины, аминокислоты; состав, получение, значение, применение
Амины, аминокислоты; состав, получение, значение, применение NaOH. Гидроксид натрия
NaOH. Гидроксид натрия Водород. Н2
Водород. Н2 Азо-, диазосоединения
Азо-, диазосоединения Почему нефть называют черным золотом
Почему нефть называют черным золотом Алкалоиды. Выделение и очистка алкалоидов
Алкалоиды. Выделение и очистка алкалоидов Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Щелочноземельные металлы. Химические свойства
Щелочноземельные металлы. Химические свойства Характеристика элементов VIII-Б группы. Семейство железа
Характеристика элементов VIII-Б группы. Семейство железа Азотсодержащие органические соединения. Амины
Азотсодержащие органические соединения. Амины Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды
Карбонилсодержащие соединения. Строение и химические свойства карбоновых кислот. Липиды. Фосфолипиды Ароматы, запахи, флюиды
Ароматы, запахи, флюиды Растворение. Растворимость веществ в воде. Классификация растворов
Растворение. Растворимость веществ в воде. Классификация растворов Электронное строение элементов-органогенов. Типы химической связи
Электронное строение элементов-органогенов. Типы химической связи Общая характеристика неметаллов
Общая характеристика неметаллов General, specific properties are common to all matters
General, specific properties are common to all matters Химия. 8 класс. Введение в химию
Химия. 8 класс. Введение в химию Окислительно-восстановительные реакции (ОВР). Лекция 6
Окислительно-восстановительные реакции (ОВР). Лекция 6