Слайд 2
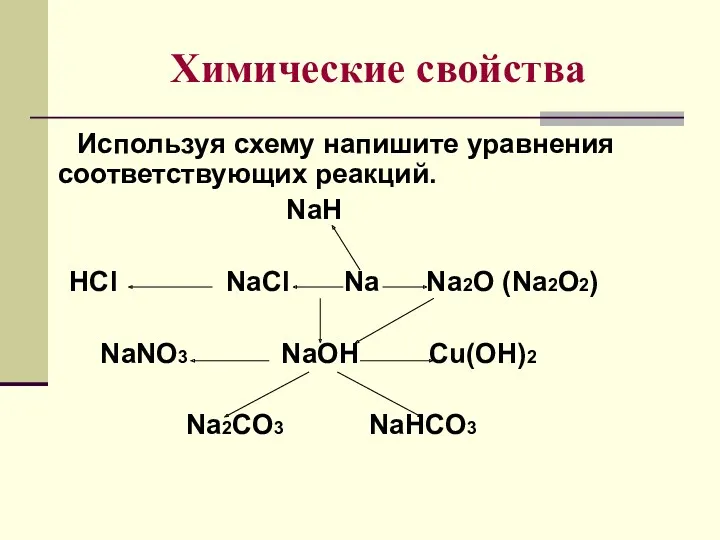
Химические свойства
Используя схему напишите уравнения соответствующих реакций.
NaH
HCl NaCl
Na Na2O (Na2O2)
NaNO3 NaOH Cu(OH)2
Na2CO3 NaHCO3
Слайд 3

Цели:
Обобщить и систематизировать знания о щелочноземельных металлах
Уметь характеризовать элементы по положению
в периодической таблице
Знать физические и химические свойства
применение соединений щелочноземельных металлов
Слайд 4

Положение в периодической таблице.
Строение атома
В периодической системе находятся в главной
подгруппе II группы.
Являются сильными восстановителями, отдают 2 ē, во всех
соединениях проявляют степень окисления +2.
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
Слайд 5
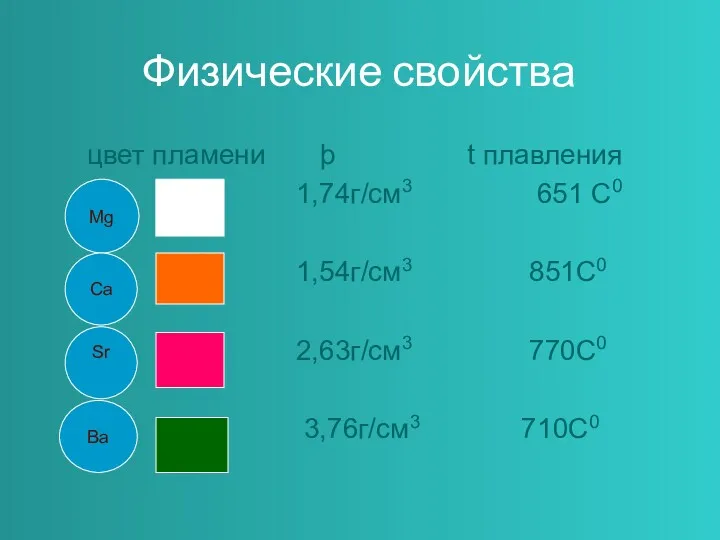
Физические свойства
цвет пламени þ t плавления
1,74г/см3 651 С0
1,54г/см3 851С0
2,63г/см3 770С0
3,76г/см3 710С0
Mg
Ca
Sr
Ba
Слайд 6
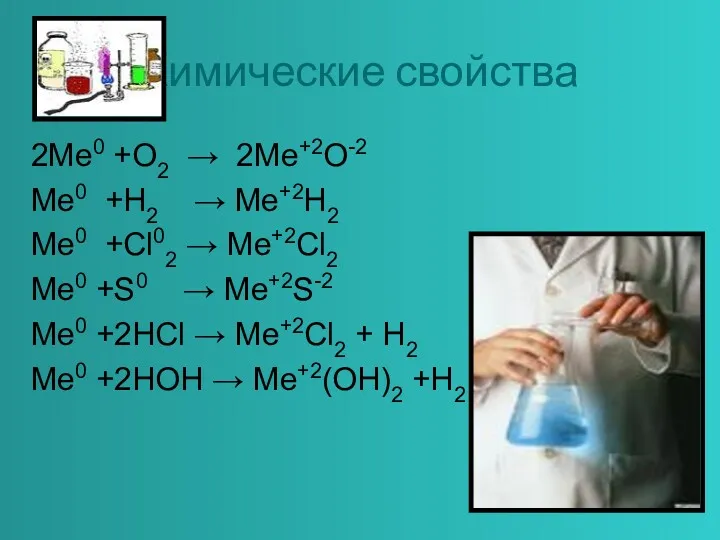
Химические свойства
2Me0 +O2 → 2Me+2O-2
Me0 +H2 → Me+2H2
Me0 +Cl02 → Me+2Cl2
Me0
+S0 → Me+2S-2
Me0 +2HCl → Me+2Cl2 + H2
Me0 +2HOH → Me+2(OH)2 +Н2
Слайд 7

Соединения щелочноземельных
металлов
Оксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с
образованием соответствующих солей.
Слайд 8
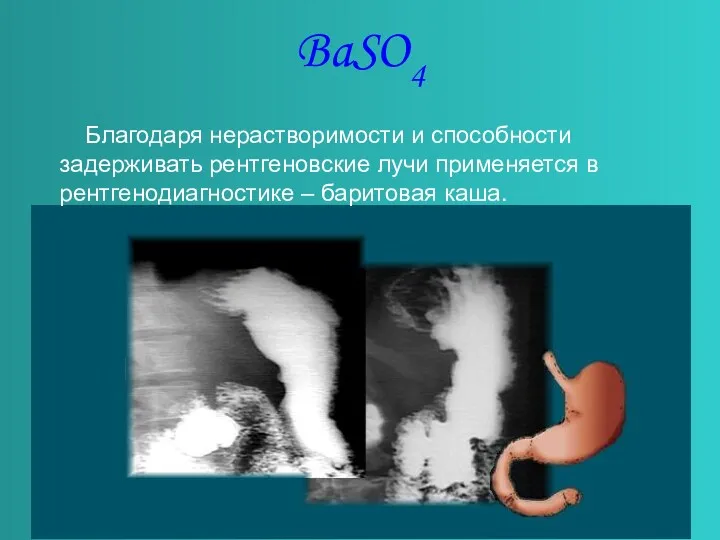
BaSO4
Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике
– баритовая каша.
Слайд 9
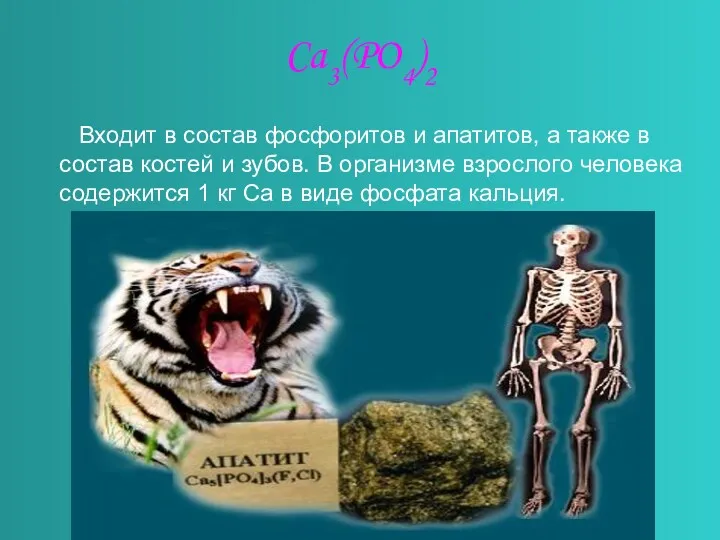
Ca3(PO4)2
Входит в состав фосфоритов и апатитов, а также в
состав костей и зубов. В организме взрослого человека содержится 1 кг Са в виде фосфата кальция.
Слайд 10

CaCO3
Карбонат кальция – одно из самых распространённых на Земле соединений.
Его содержат горные породы – мел, мрамор, известняк.
Слайд 11

CaSO4∙ 2H2O
Встречается в природе в виде минерала гипса, представляющего
собой кристаллогидрат. Используется в строительстве, в медицине для наложения гипсовых повязок, для получения слепков.
Слайд 12

MgCO3
Широко применяется в производстве стекла, цемента, кирпича, а также в
металлургии для перевода пустой породы в шлак.
Слайд 13

Са(ОН)2
Гидроксид кальция или гашёная известь с песком и водой называется
известковым раствором и широко используется в строительстве. При нагревании разлагается на оксид и воду.
Слайд 14

Проверка знаний
Сравните атомы элементов, поставив знаки <, > или =
вместо *:
а) заряд ядра: Mg * Ca, Na *Mg, Ca * К;
б) число электронных слоев: Mg * Ca, Na * Mg,
Ca * К;
в) число электронов на внешнем уровне: Mg * Ca, Na *Mg, Ca * К;
г) радиус атома: Mg * Ca, Na * Mg, Ca * K;
д) восстановительные свойства: Mg * Ca, Na * Mg,
Ca * K.
Слайд 15

Проверь себя
(самостоятельная работа )
Дополните схемы взаимодействия щелочноземельных
металлов с неметаллами общими формулами и названиями продуктов реакции.
Запишите конкретные уравнения реакции, расставив коэффициенты в них методом электронного баланса:
а) М+ S ____________ б) М+ N2 ____________________________
в) М+ Н 2 _____________ г) М+ С12 ___________________
Пример: ___________________ Пример: _________________________
Допишите уравнения реакций:
а) Са + H2O→ ……………………….
б) Mg + НСl→……………………….
в) Ва + О2→………………………..
Осуществить превращения по схеме:
Ме → МеО → Ме(ОН)2 → МеSО4














 Предмет и объекты исследования коллоидной химии. Лекция 01
Предмет и объекты исследования коллоидной химии. Лекция 01 Промышленное производство аммиака
Промышленное производство аммиака Rates of reaction
Rates of reaction Алюминий и его сплавы
Алюминий и его сплавы Алкины. Самостоятельная работа
Алкины. Самостоятельная работа Тепловой эффект химической реакции. Топливо. Водород. 8 класс
Тепловой эффект химической реакции. Топливо. Водород. 8 класс Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Бензен. Номенклатура. Хімічні властивості
Бензен. Номенклатура. Хімічні властивості Химические уравнения
Химические уравнения Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева An introduction to the chemistry of alkenes
An introduction to the chemistry of alkenes Химия. Отличие химических свойств от физических
Химия. Отличие химических свойств от физических Ертінділер. Ерітінді концентрациясын білдіру тәсілдері
Ертінділер. Ерітінді концентрациясын білдіру тәсілдері Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Закон сохранения массы веществ
Закон сохранения массы веществ Дисперсные системы
Дисперсные системы Производство чугуна и стали
Производство чугуна и стали Характеристика строения и свойств химических элементов
Характеристика строения и свойств химических элементов Лигандообменные равновесия и процессы. Строение комплексных соединений
Лигандообменные равновесия и процессы. Строение комплексных соединений Физические явления – основа разделения смесей в химии (урок химии в 8 классе)
Физические явления – основа разделения смесей в химии (урок химии в 8 классе) Хлороводород. Соляная кислота
Хлороводород. Соляная кислота Окисление и восстановление
Окисление и восстановление Классификация химических реакций
Классификация химических реакций Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Водород, получение, свойства и применение
Водород, получение, свойства и применение Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага
Швидкість та механізм хімічних реакцій. Каталіз. Хімічна рівновага Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага