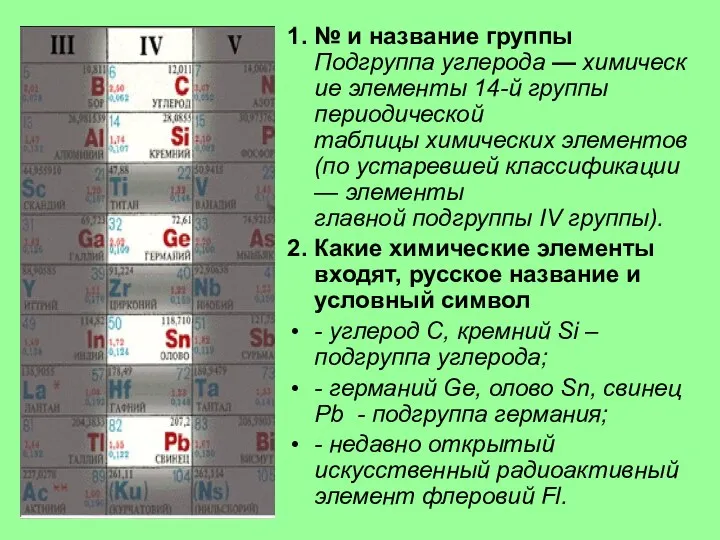
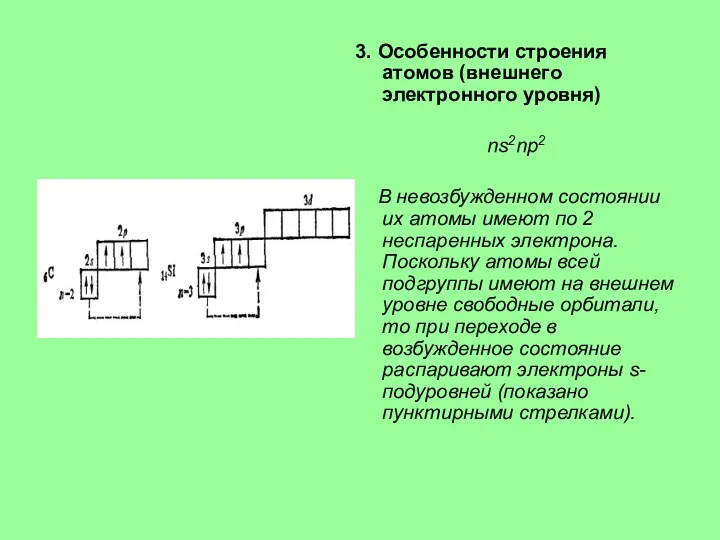
4. Характерные степени окисления
В соединениях элементы подгруппы углерода проявляют степень
окисления +4 и 4, а также +2, причем последняя с увеличением заряда ядра становится более характерной. Для углерода, кремния и германия наиболее типична степень окисления +4, для свинца +2. Степень окисления 4 в последовательности С→Рb становится все менее характерной.
5. Состав и свойства соединений
Оксиды общей формулы RO2 и RO,
Водородные соединения — формулы RH4.
Гидраты высших оксидов углерода и кремния обладают кислотными свойствами, гидраты остальных элементов амфотерны, причем кислотные свойства сильнее выражены у гидратов германия, а основные — у гидратов свинца. От углерода к свинцу уменьшается прочность водородных соединений RH4 : С H4 - прочное вещество, а РbН4 в свободном виде не выделено.
В подгруппе с ростом порядкового номера уменьшается энергия ионизации атома и увеличивается атомный радиус т. е. неметаллические свойства ослабевают, а металлические усиливаются.







 Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Качественные реакции на анионы
Качественные реакции на анионы Застосування радіонуклідів у медицині, тваринництві та археології
Застосування радіонуклідів у медицині, тваринництві та археології Химическая технология. Введение
Химическая технология. Введение Загальні способи добування солей. Класифікація неорганічних речовин
Загальні способи добування солей. Класифікація неорганічних речовин Электролитическая диссоциация
Электролитическая диссоциация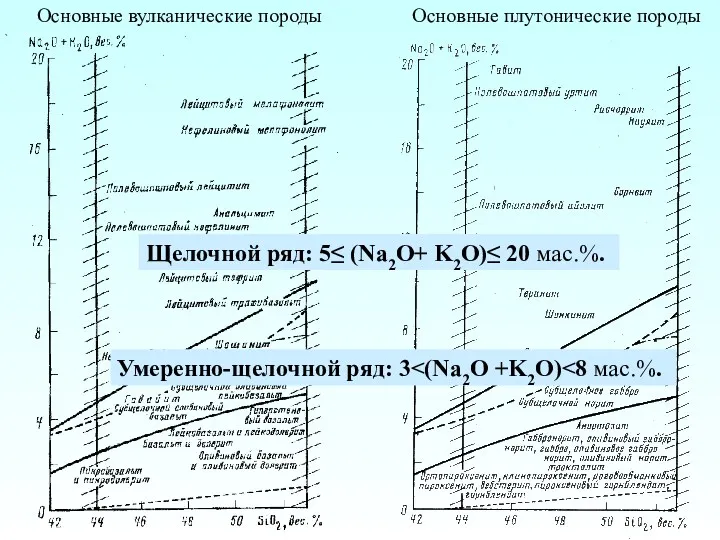 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Метод МО
Метод МО Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Аммиак. Физические и химические свойства. Получение, применение
Аммиак. Физические и химические свойства. Получение, применение Ерітінділер туралы ілім. Буферлік ерітінділер
Ерітінділер туралы ілім. Буферлік ерітінділер Гидролиз. Применение гидролиза. (11 класс)
Гидролиз. Применение гидролиза. (11 класс) Электронно-ионный баланс и Закон Авогадро. 8 класс
Электронно-ионный баланс и Закон Авогадро. 8 класс Атом. Будова атома
Атом. Будова атома Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Алканы нефти. Содержание алканов в нефтяных фракциях
Алканы нефти. Содержание алканов в нефтяных фракциях Растворы. Лекция 7
Растворы. Лекция 7 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Виды химической связи
Виды химической связи Профілактика захворювань незбалансованого харчування. Харчові добавки
Профілактика захворювань незбалансованого харчування. Харчові добавки Первая группа периодической системы Менделеева. Щелочные металлы
Первая группа периодической системы Менделеева. Щелочные металлы Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері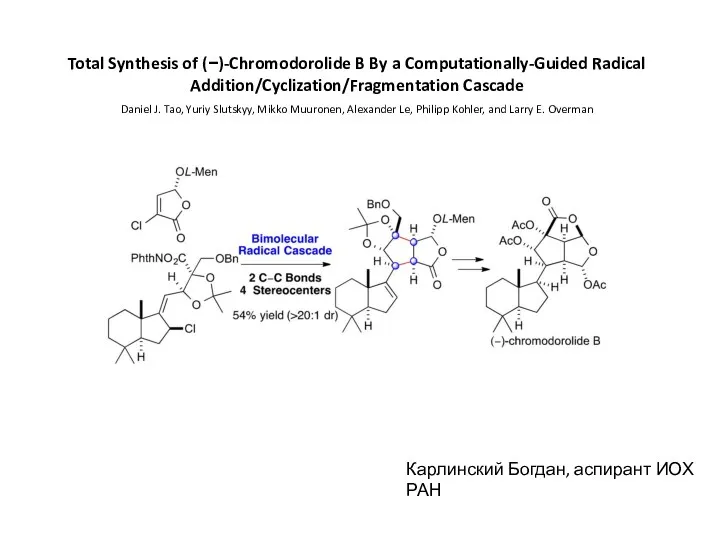 Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical
Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical Чистые вещества и смеси
Чистые вещества и смеси