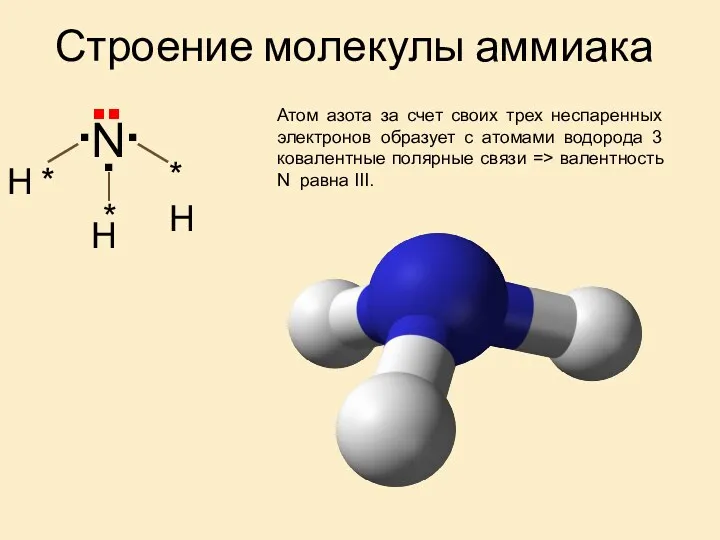
Химические свойства аммиака
Реакции, идущие
с изменением степени окисления азота
NH3 – сильный
восстановитель
без изменения степени окисления азота
NH3 – слабое основание
1. Аммиак – непрочное соединение,
при нагревании разлагается:
2NH3 ⬄ N2 + 3H2
2. Аммиак горит в кислороде:
NH3 + O2 → N2 + H2O
3. Окисление аммиака кислородом воздуха в присутствии катализатора:
NH3 + O2 NО + H2O
Pt, Rh
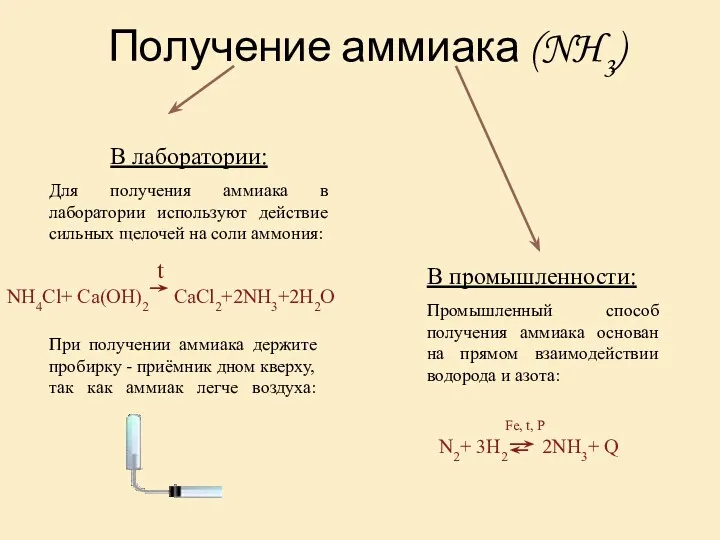
1. Аммиак реагирует с водой:
NH3 + H2O⬄ NH4OH⬄ NH4+ + OH−
гидроксид аммония
2. Аммиак реагирует с кислотами:
NH3 + HCl → NH4Cl
хлорид аммония



 Шкідливі хімічні речовини, забруднювачі атмосфери
Шкідливі хімічні речовини, забруднювачі атмосфери Свойства идеального газа на примере воздуха
Свойства идеального газа на примере воздуха Многоядерные ароматические углеводороды
Многоядерные ароматические углеводороды Methods for processing of liquid waste
Methods for processing of liquid waste Оксиды серы. Сернистая кислота
Оксиды серы. Сернистая кислота Chem reactions. Different Typesof Chemical Reactions
Chem reactions. Different Typesof Chemical Reactions Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Альдегиды и кетоны
Альдегиды и кетоны Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления
Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления Развитие теории восстановления металлов
Развитие теории восстановления металлов Азотная кислота
Азотная кислота Уравнения химических реакций. Алгоритм расстановки коэффициентов
Уравнения химических реакций. Алгоритм расстановки коэффициентов Альдегидтер
Альдегидтер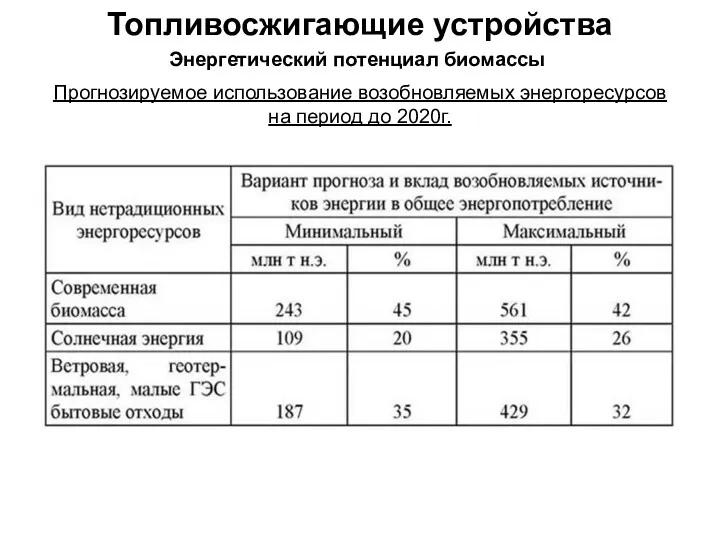 Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо
Топливо и топливосжигающие устройства. Энергетический потенциал биомассы. Переработка биомассы в топливо Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага Энергетикалық деңгейлер
Энергетикалық деңгейлер Кислоты. 8 класс
Кислоты. 8 класс Окислительно-восстановительные реакции. Готовимся к ЕГЭ
Окислительно-восстановительные реакции. Готовимся к ЕГЭ Жёсткость воды
Жёсткость воды Физические и химические свойства алканов
Физические и химические свойства алканов Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)
Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды) Окислительно-восстановительные реакции. Генетический ряд кальция
Окислительно-восстановительные реакции. Генетический ряд кальция альдегиды, свойства, получение
альдегиды, свойства, получение Сера. Аллотропные модификации
Сера. Аллотропные модификации Химическая промышленность и химическая технология
Химическая промышленность и химическая технология Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування