Содержание
- 2. С1 – газ с резким запахом С2 – С3 – жидкости с резким запахом С4 –
- 3. ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИЯ ВОССТАНОВЛЕНИЯ О СН3 С + Н2 →СН3 СН2 ОН этанальН этанол CH3 –
- 4. R – C = O + [O] → R – C = O H OH альдегид
- 5. ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИИ ОКИСЛЕНИЯ Реакция серебряного зеркала- качественная реакция О О СН3 С + 2[Ag(NH3)2]OH →
- 6. Реакция с гидроксидом меди(II) качественная реакция О О СН3 С + 2Cu(OH)2 → СН3 С +
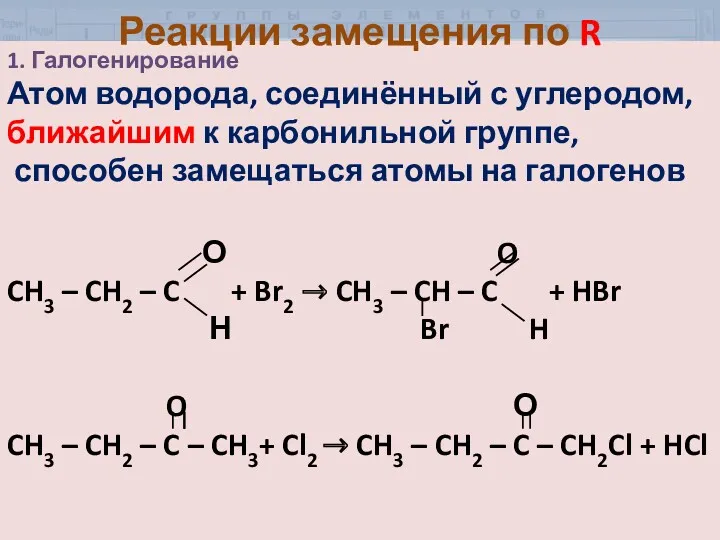
- 7. 1. Галогенирование Атом водорода, соединённый с углеродом, ближайшим к карбонильной группе, способен замещаться атомы на галогенов
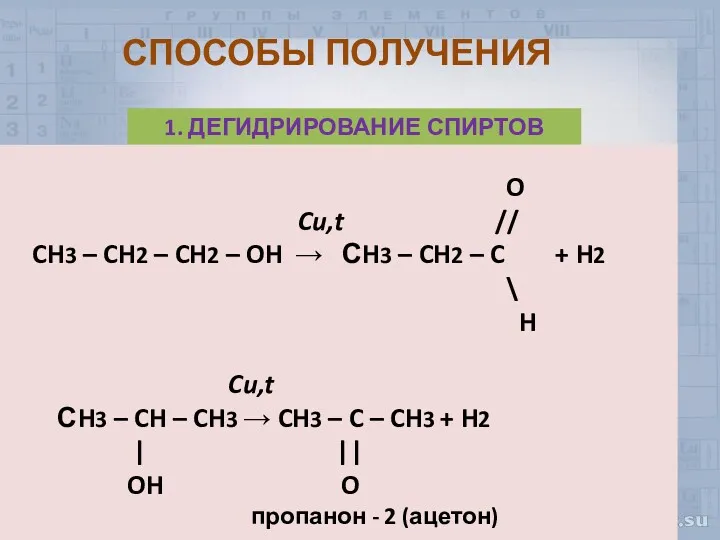
- 8. СПОСОБЫ ПОЛУЧЕНИЯ 1. ДЕГИДРИРОВАНИЕ СПИРТОВ O Cu,t // CH3 – CH2 – CH2 – OH →
- 9. СПОСОБЫ ПОЛУЧЕНИЯ 2. ОКИСЛЕНИЕ СПИРТОВ Составьте уравнение окисления CuO этилового спирта(см. химические свойства спиртов) 2. ОКИСЛЕНИЕ
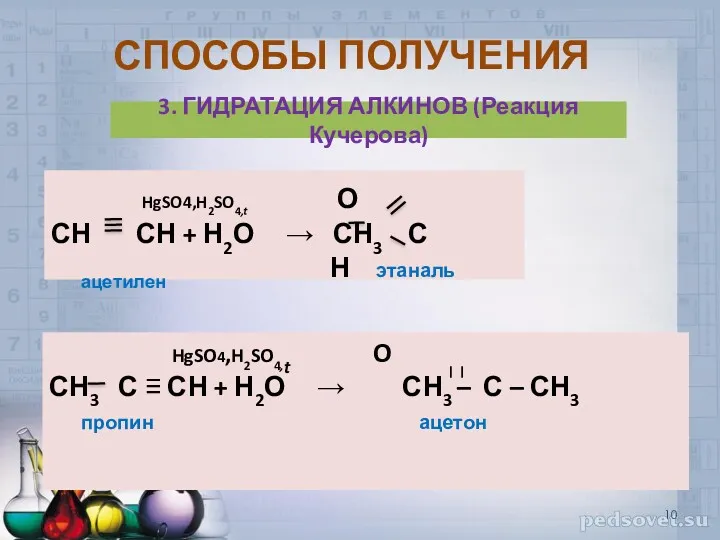
- 10. СПОСОБЫ ПОЛУЧЕНИЯ 3. ГИДРАТАЦИЯ АЛКИНОВ (Реакция Кучерова) HgSO4,H2SO4,t О СН СН + Н2О → СН3 С
- 11. Применение альдегидов Производство лекарств В сельском хозяйстве для протравливания семян Производство пластмасс В кожевенной промышленности Для
- 12. ПРИМЕНЕНИЕ АЛЬДЕГИДОВ ПАРФЮМЕРИЯ Альдегид анисовый, обепин – жидкость с приятным запахом мимозы Альдегид дециловый, деканаль –
- 14. Скачать презентацию


![R – C = O + [O] → R –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/220421/slide-3.jpg)




 Неметаллические материалы
Неметаллические материалы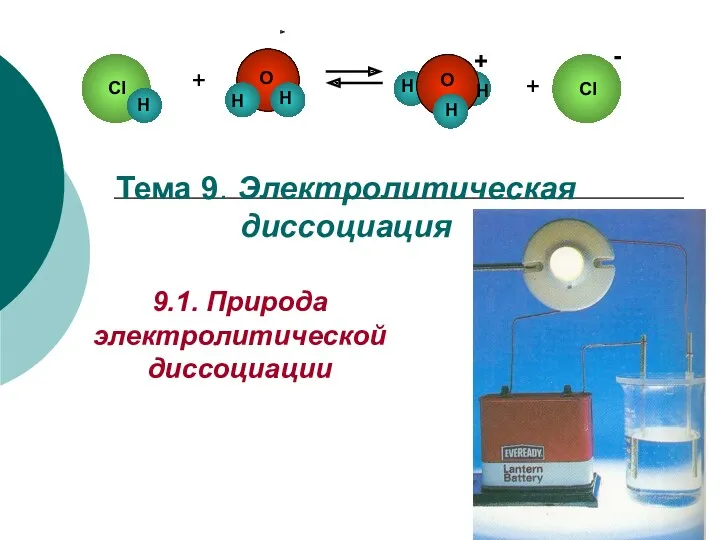 Электролитическая диссоциация
Электролитическая диссоциация Основные характеристики клеев
Основные характеристики клеев Взаємодія кисню із складними речовинами
Взаємодія кисню із складними речовинами Полимеры. Мономер
Полимеры. Мономер Растворы электролитов и неэлектролитов. Ионное произведение воды
Растворы электролитов и неэлектролитов. Ионное произведение воды Инструменты и приспособления для химической завивки волос
Инструменты и приспособления для химической завивки волос Хлорид натрия
Хлорид натрия Органическая химия. Жиры
Органическая химия. Жиры Пластмассы, синтетические каучуки
Пластмассы, синтетические каучуки Продукция UNIL
Продукция UNIL Глины каолиновые и каолино-гидрослюдистые
Глины каолиновые и каолино-гидрослюдистые Химический элемент кремний
Химический элемент кремний Магматические горные породы
Магматические горные породы Супрамолекулярная химия - молекулярная социология
Супрамолекулярная химия - молекулярная социология Углеводы. Сn(H2O)m – общая формула углеводов
Углеводы. Сn(H2O)m – общая формула углеводов Общая электронная формула внешнего слоя
Общая электронная формула внешнего слоя Простые вещества
Простые вещества Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Незвичайна вода
Незвичайна вода Фунгициды. Достоинства и недостати
Фунгициды. Достоинства и недостати Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8)
Общая характеристика отравляющих и высокотоксичных веществ. (Тема 8) Алкадиены
Алкадиены Производство цемента. Сухой цемент
Производство цемента. Сухой цемент Коррозия металлов
Коррозия металлов ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов
ГИА. Вопрос А9. Химические свойства простых веществ: металлов и неметаллов Коррозия металлов и способы защиты от неё. (11 класс)
Коррозия металлов и способы защиты от неё. (11 класс)