Содержание
- 2. Как же химики судят о том, является ли данное вещество кислотой? Растворы всех кислот на вкус
- 3. 1)Что такое индикаторы? 2)Какие индикаторы вы знаете? 3) Как индикаторы меняют цвет в щелочной среде?
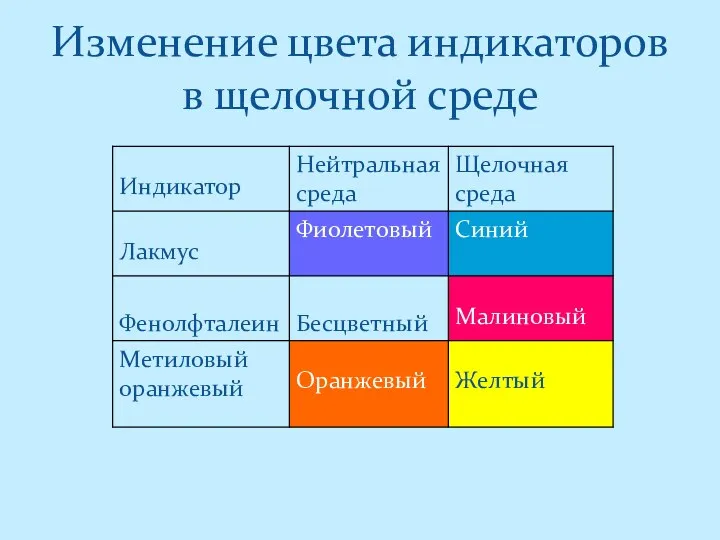
- 4. Изменение цвета индикаторов в щелочной среде
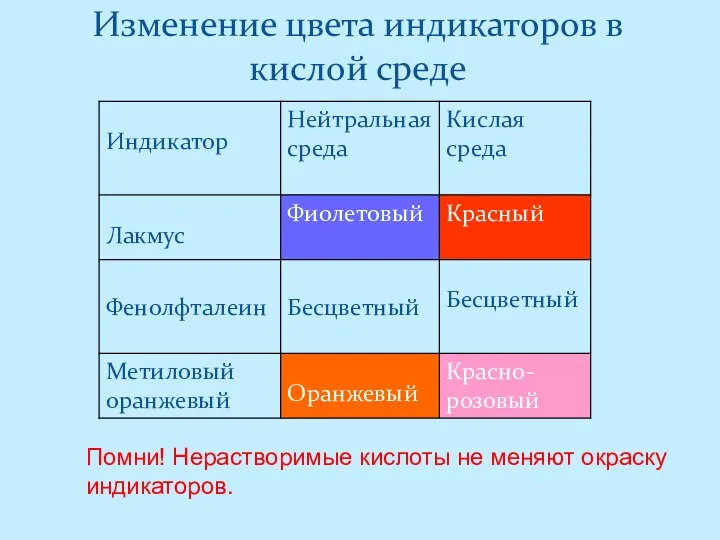
- 5. Изменение цвета индикаторов в кислой среде Помни! Нерастворимые кислоты не меняют окраску индикаторов.
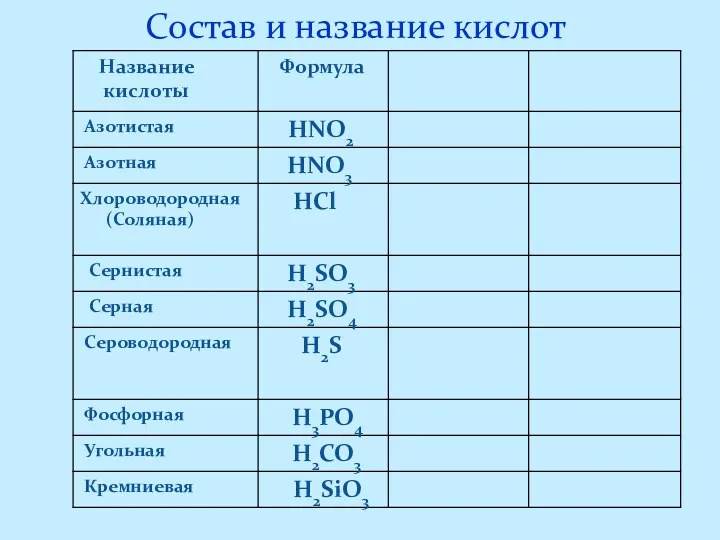
- 6. Состав и название кислот
- 7. Кислоты – это сложные вещества, молекулы, которых состоят из атомов водорода и кислотных остатков
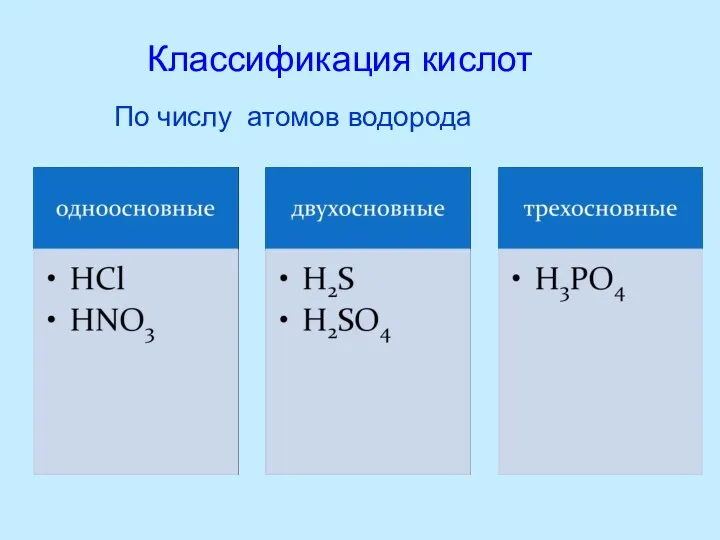
- 8. По числу атомов водорода Классификация кислот
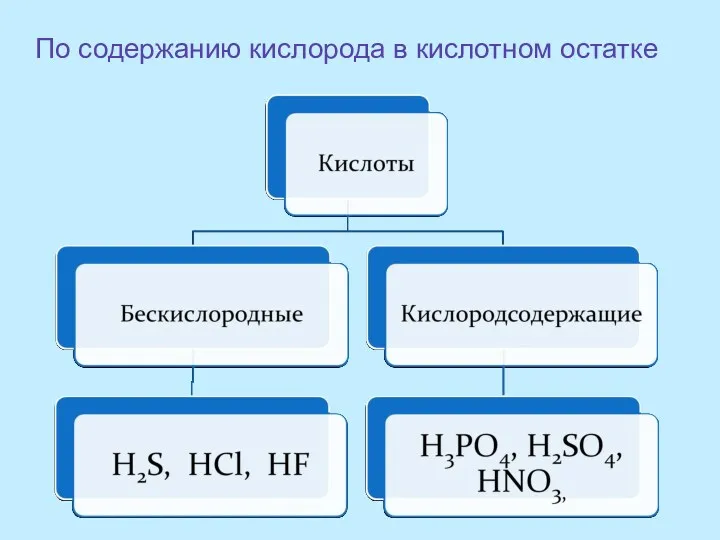
- 9. По содержанию кислорода в кислотном остатке
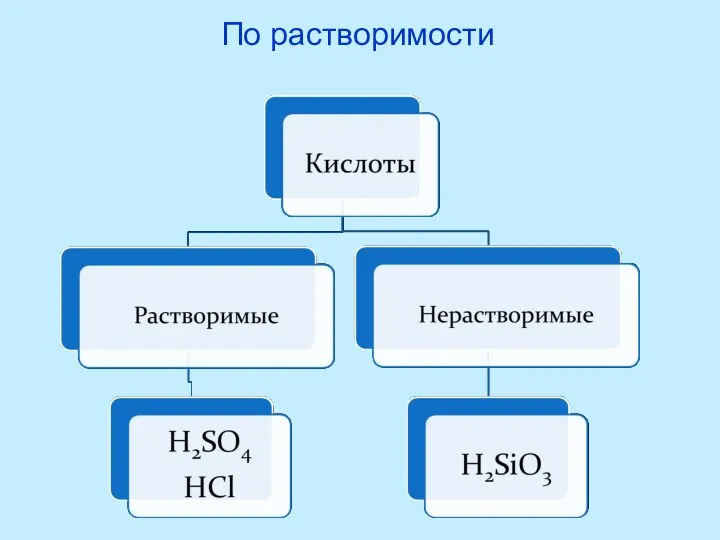
- 10. По растворимости
- 13. Серная кислота бесцветная , вязкая жидкость, без запаха, вдвое тяжелее воды, поглощает влагу из воздуха и
- 14. Обугливание лучинки серной кислотой
- 15. Обугливание сахара серной кислотой
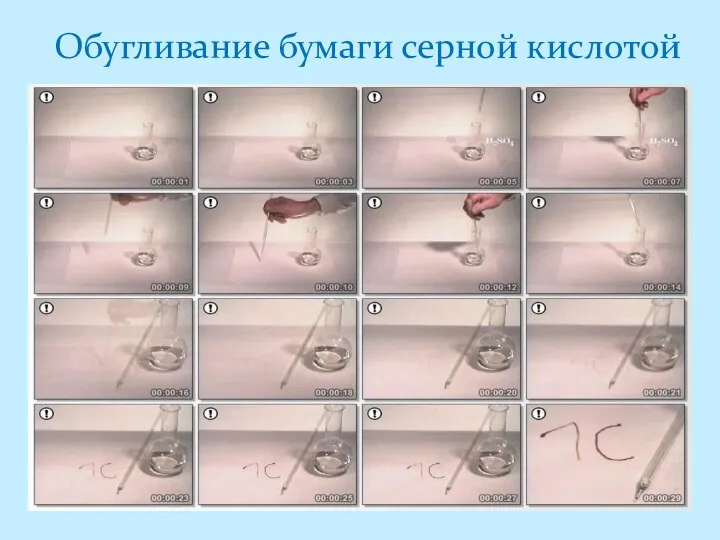
- 16. Обугливание бумаги серной кислотой
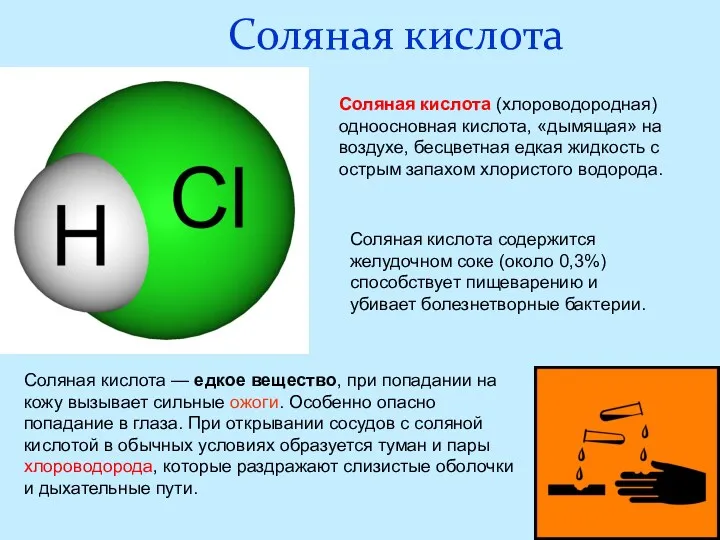
- 17. Соляная кислота Соляная кислота содержится желудочном соке (около 0,3%) способствует пищеварению и убивает болезнетворные бактерии. Соляная
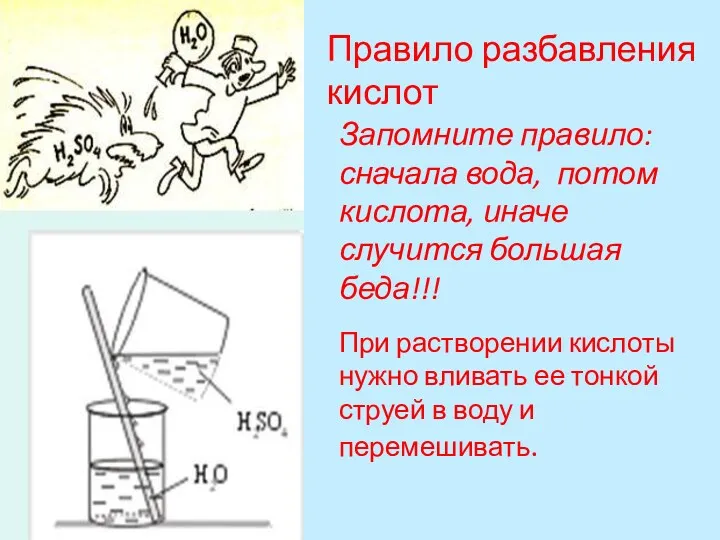
- 18. Правило разбавления кислот При растворении кислоты нужно вливать ее тонкой струей в воду и перемешивать. Запомните
- 20. ЕСЛИ КИСЛОТА ПОПАЛА НА КОЖУ. Пораженный участок кожи промывают сильно скользящей струей холодной воды в течение
- 21. H2CO3 → CO2↑ + H2O H2SO3 → SO2↑ + H2O В свободном виде не существуют. Они
- 22. Как узнать какие оксиды соответствуют данным кислотам? Помните, что суммарная степень окисления атомов всех элементов в
- 23. Проверь себя Выберите группу веществ, в состав которой входят только кислоты HCl, SO3, NaOH,CuCl2 HNO3, H2S,
- 24. Проверь себя Выберите группу веществ, в состав которой входят только двухосновные кислоты HNO3, H2S, HCl, H3PO4
- 25. HNO3, H2S, HCl, H2CO3 HCl, H2SO4, H2SiO3, H2SO3 H2S, HNO3, H2SO3, H3PO4 HNO3, H2SO4, H3PO4, HNO2
- 26. Проверь себя В кислой среде синий лакмус становится: фиолетовым красным малиновым не изменяет окраску
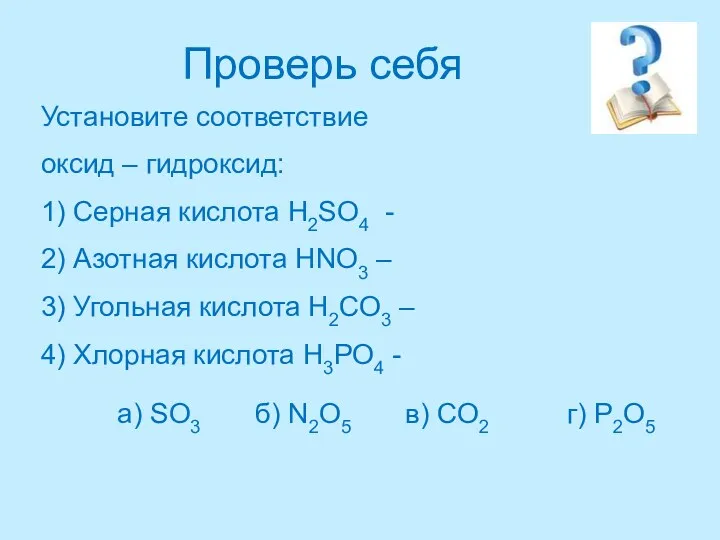
- 27. Проверь себя Установите соответствие оксид – гидроксид: 1) Серная кислота H2SO4 - 2) Азотная кислота HNO3
- 28. Вспомните правило разбавления кислот
- 30. Скачать презентацию
















 Супрамолекулярная химия - молекулярная социология
Супрамолекулярная химия - молекулярная социология Свойства растворов электролитов
Свойства растворов электролитов Crystal Defects and Noncrystalline Structure–Imperfection
Crystal Defects and Noncrystalline Structure–Imperfection Химическая связь и ее типы
Химическая связь и ее типы Процессы и операции формообразования. Неметаллические материалы
Процессы и операции формообразования. Неметаллические материалы Типы химических реакций
Типы химических реакций бензол
бензол Basis Sets and Pseudopotentials
Basis Sets and Pseudopotentials Атомно-кристаллическое строение
Атомно-кристаллическое строение Монокристаллы InSb. Свойства, выращивание, применение
Монокристаллы InSb. Свойства, выращивание, применение большая стирка
большая стирка Способи очищення води
Способи очищення води Основные интермедиаты в органических реакциях. Часть 1
Основные интермедиаты в органических реакциях. Часть 1 Алюминий
Алюминий Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Алкены. Полиэтилен
Алкены. Полиэтилен Мартенситное превращение
Мартенситное превращение Вода — это уникальное вещество
Вода — это уникальное вещество Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Исследование снега
Исследование снега Химическая связь
Химическая связь Химические свойства альдегидов
Химические свойства альдегидов Обмен нуклеотидов
Обмен нуклеотидов Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств Elements of group 2 (IIA)
Elements of group 2 (IIA)