Содержание
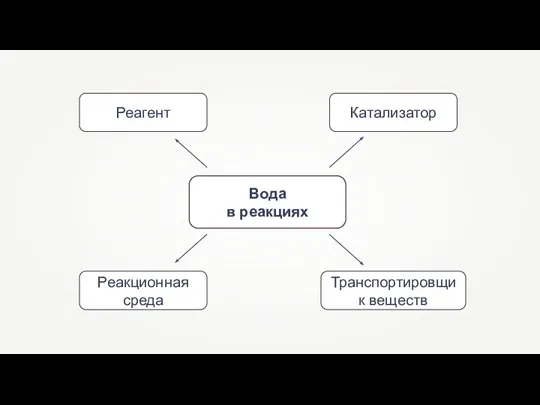
- 2. Вода в реакциях
- 3. Классификация веществ по растворимости в воде
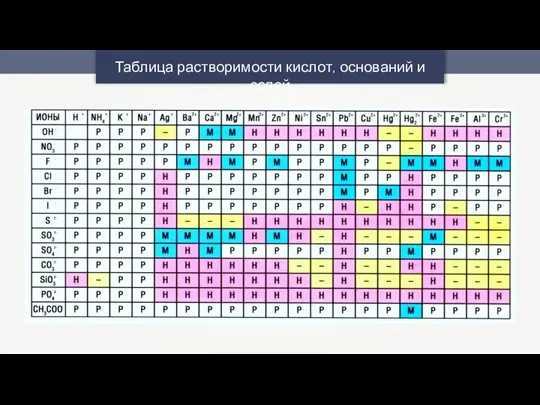
- 4. Таблица растворимости кислот, оснований и солей
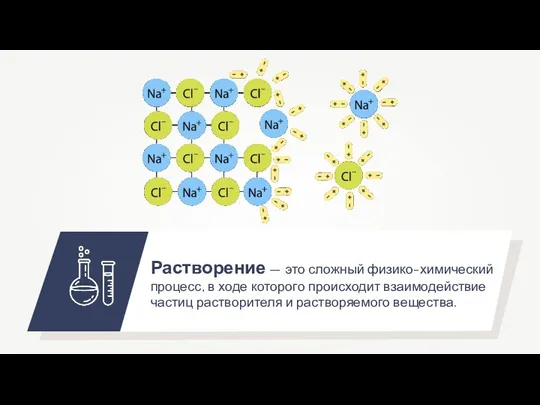
- 5. Растворение — это сложный физико-химический процесс, в ходе которого происходит взаимодействие частиц растворителя и растворяемого вещества.
- 6. Растворение
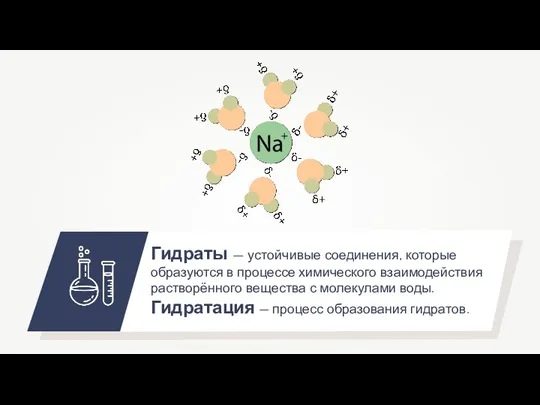
- 7. Гидраты — устойчивые соединения, которые образуются в процессе химического взаимодействия растворённого вещества с молекулами воды. Гидратация
- 8. Кристаллогидрат — кристалл, содержащий в своём составе воду. Кристаллизационная вода — вода, входящая в состав кристаллогидрата.
- 9. Примеры кристаллогидратов
- 10. Д.И. Менделеев 1834–1907 гг. Русский учёный. Предложил гидратную теорию растворов.
- 11. Электролиты — вещества, которые в растворах распадаются на ионы — диссоциируют.
- 12. Степень электролитической диссоциации — величина равная отношению числа молей вещества, которое диссоциировало, к общему количеству растворённого
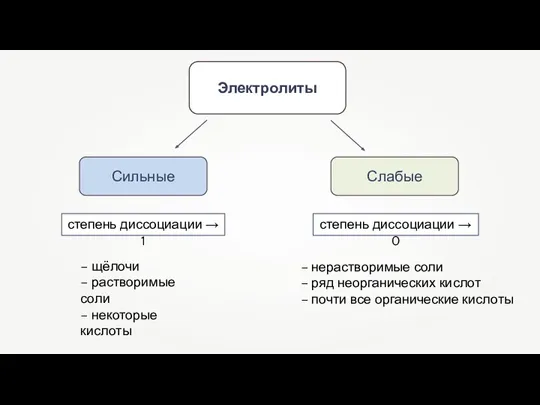
- 13. Электролиты степень диссоциации → 1 степень диссоциации → 0 – щёлочи – растворимые соли – некоторые
- 14. Диссоциация сильных электролитов KOH = K + OH H2SO4 = 2H + SO4 + – +
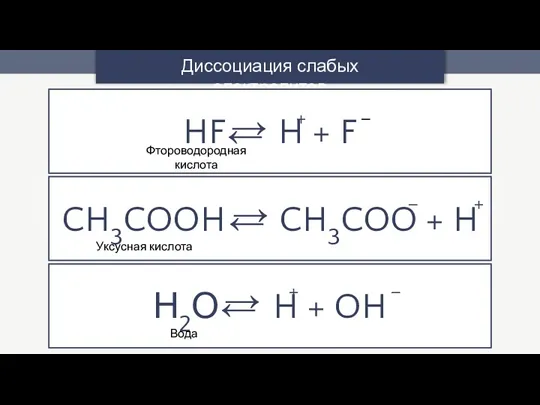
- 15. Диссоциация слабых электролитов HF ↔ H + F CH3COOH ↔ CH3COO + H + – –
- 16. С. Аррениус 1859–1927 гг. И.А. Каблуков 1857–1942 гг. В.А. Кистяковский 1865–1952 гг. Теория, которая объясняет электропроводность
- 17. Классификация электролитов в зависимости от образуемых в результате диссоциации ионов
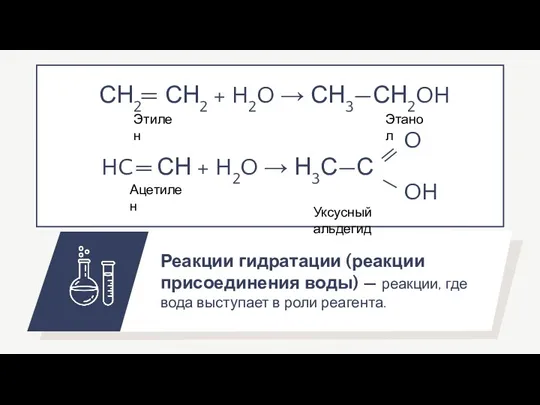
- 18. Реакции гидратации (реакции присоединения воды) — реакции, где вода выступает в роли реагента. Этилен Ацетилен Этанол
- 19. Взаимодействие щелочных и щёлочноземельных металлов с водой 2К + 2Н2О = 2КОН + Н2↑ Са +
- 20. Взаимодействие галогенов с водой 2F2 + 2Н2О = 4HF + O2↑ Cl2 + Н2О = HCl
- 21. Взаимодействие воды с основными и кислотными оксидами Н2О + СаО = Са(ОН)2 Н2О + СО2 =
- 23. Скачать презентацию













 Медь и её соединения
Медь и её соединения Вода. Практическая работа
Вода. Практическая работа Синтез, фото- и ионохромные свойства спиропиранов на основе гидроксихинолинового альдегида
Синтез, фото- и ионохромные свойства спиропиранов на основе гидроксихинолинового альдегида Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Катенаны. Ротаксаны (лекция 6)
Катенаны. Ротаксаны (лекция 6) Химия 8 класс. Введение в химию
Химия 8 класс. Введение в химию Химические процессы зоны гипергенеза
Химические процессы зоны гипергенеза Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Вода - вещество обычное или необычное
Вода - вещество обычное или необычное Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений
Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений Алюминий. Схема расположения электронов на энергетических подуровнях
Алюминий. Схема расположения электронов на энергетических подуровнях Методы очистки натрия от примесей
Методы очистки натрия от примесей Амины
Амины Органические вещества
Органические вещества Кислотність та основність органічних сполук
Кислотність та основність органічних сполук Электролитическая диссоциация
Электролитическая диссоциация Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Состояние и свойства воды
Состояние и свойства воды Properties of Atoms and the Periodic Table
Properties of Atoms and the Periodic Table Электролитическая диссоциация
Электролитическая диссоциация Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Явища природи. Фізичні явища, їх різноманітність. Хімічні явища, їх ознаки. Горіння. Гниття
Явища природи. Фізичні явища, їх різноманітність. Хімічні явища, їх ознаки. Горіння. Гниття Дисперсные системы
Дисперсные системы Предмет аналитической химии, ее структура
Предмет аналитической химии, ее структура Металлы
Металлы Химия и сельское хозяйство
Химия и сельское хозяйство Использование информационных технологий при обучении химии
Использование информационных технологий при обучении химии Алкины. Самостоятельная работа
Алкины. Самостоятельная работа