Содержание
- 2. Ура, листок! 10 увлекательных задач Сдать до начала каникул За каждую не сданную задачу - 2
- 3. Однородные Кристаллизация Дистилляция Хроматография Выпаривание При нагревании растворитель испаряется, а растворённое вещество выпадает в осадок. Смеси
- 4. Однородные Кристаллизация Дистилляция Хроматография Выпаривание Часто вещество само кристаллизуется из раствора, без дополнительного выпаривания. Смеси
- 5. Однородные Кристаллизация Дистилляция Хроматография Выпаривание Дистилляция (перегонка) – метод разделения однородных смесей, основанный на их различающихся
- 6. Однородные Кристаллизация Хроматография Выпаривание Дистилляция Хромотография - метод разделения, анализа. Обычно основана на распределении исследуемого вещества
- 7. Привести 5 примеров веществ и 5 материалов. Попробуйте придумать что-нибудь интересное. Вы добавили в борщ слишком
- 8. Однородные Кристаллизация Хроматография Выпаривание Дистилляция Хромотография - метод разделения, анализа. Обычно основана на распределении исследуемого вещества
- 9. Хроматография
- 10. Явление - вообще всякое обнаруживаемое проявление чего-нибудь (Словарь Ожегова). Физическое явление – такие явления, при которых
- 11. Для химических реакций характерно следующие: Выделение теплоты и/или света Смешивание серной кислоты и воды Признаки химических
- 12. Для химических реакций характерно следующие: Выделение теплоты и/или света Изменение окраски или обесцвечивание 2KMnO4 + H2O2
- 13. Для химических реакций характерно следующие: Выделение теплоты и/или света Изменение окраски или обесцвечивание Появление запаха NH4OH-->
- 14. Для химических реакций характерно следующие: Выделение теплоты и/или света Изменение окраски или обесцвечивание Появление запаха Образование
- 15. Для химических реакций характерно следующие: Выделение теплоты и/или света Изменение окраски или обесцвечивание Появление запаха Образование
- 16. 1. Приведение веществ в тесное соприкосновение (измельчение, перемешивание, растворение) . 2. Нагревание веществ до определённой температуры.
- 17. 1. Приведение веществ в тесное соприкосновение (измельчение, перемешивание, растворение) . 2. Нагревание веществ до определённой температуры.
- 18. ХИМИЯ 8 класс Атомы и молекулы. Простые и сложные вещества. Мария Дмитриевна Смирнова Smirnova@sch2101.ru Vk.com/masha2101
- 19. Вещества бывают молекулярного и немолекулярного строения. Молекулярные соединения Немолекулярные соединения NaCl K2SO4 LiH CaO CH4 H2O
- 20. H2O, жидкость Mg2SiO2 Кристаллическое вещество Молекулярное вещество Молекулярные и немолекулярные вещества
- 21. H2O, жидкость H2O, лёд Кристаллическое вещество Молекулярное вещество Молекулярные и немолекулярные вещества
- 22. В твёрдых и жидких телах существует упорядоченность во взаимном расположении атомов или молекул. Упорядоченность на расстояниях,
- 23. Дальний порядок Ближний порядок Безпорядок Порядок
- 24. Простые и сложные вещества Состоит только из себя Является сочетанием
- 25. Если вещество можно разложить на другие вещества – оно является сложным. Сложные вещества – такие вещества,
- 26. Различие смесей и химических соединений
- 27. Химический элемент – определенный тип атомов. Химический элемент – это вид атомов с определённым зарядом ядра.
- 28. Почти все символы для химических элементов придумал Якоб Берцелиус. Он предложил присваивать символ по первой букве
- 29. Символы химических элементов Алхимические символы 1 — олово; 2 — свинец; 3 — золото; 4 —
- 30. Названия химических элементов
- 31. Названия химических элементов
- 32. Названия химических элементов
- 33. 8 22.09.2016 Символы химических элементов
- 34. Одной из характеристик атома является его масса. Только она очень мала, масса атома С – 1.99*10-23г.
- 35. С имеет массу 12 а.е.м. Давайте посчитаем, какая масса у Н и О в а.е.м. Мн=
- 36. Относительная атомная масса элемента Аr показывает, во сколько раз масса его атома больше двенадцатой части атома
- 37. Относительная атомная масса элемента Аr показывает, во сколько раз масса его атома больше двенадцатой части атома
- 38. 2H2 + O2 = 2H2O Массы водорода и кислорода должны относиться как 1:8 для задействование всего
- 39. H2O Эта формула означает, что на 1 атом кислорода приходится 2 атома кислорода. Относительная атомная масса
- 40. Получается, что в каких пропорциях ни возьми H и О образуется вода (Н2О). А значит химический
- 41. Определить массу серы, реагирующей без остатка с 5 г медных опилок, если медь и сера в
- 42. Если химическое вещество имеет постоянный состав, то его можно выразить через химическую формулу. Химическая формула –
- 43. 6Fe(OH)3 3 SnO2 10HNO3 Индексы Коэффициенты Химические формулы
- 45. Скачать презентацию
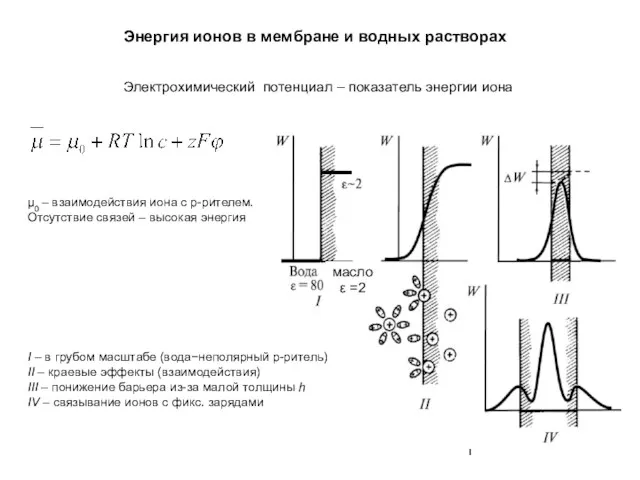 Энергия ионов в мембране и водных растворах
Энергия ионов в мембране и водных растворах Хром. Свойства
Хром. Свойства Химические вещества, как строительные и поделочные материалы
Химические вещества, как строительные и поделочные материалы Ацидиметрия. Стандартизация
Ацидиметрия. Стандартизация Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Теобромин
Теобромин Морфология тел полезных ископаемых
Морфология тел полезных ископаемых Изучение зависимости между химическим составом, структурой и свойствами чугунов
Изучение зависимости между химическим составом, структурой и свойствами чугунов Алкадиены. Непредельные углеводороды
Алкадиены. Непредельные углеводороды Строение атома. Химия. 11 класс
Строение атома. Химия. 11 класс Требования к осадителю
Требования к осадителю Электроотрицательность химических элементов
Электроотрицательность химических элементов Фазовые равновесия и учение о растворах
Фазовые равновесия и учение о растворах Қанықпаған майлар және соның негізіндегі БАЗ
Қанықпаған майлар және соның негізіндегі БАЗ Арены. Бензол
Арены. Бензол Белки
Белки Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Аргентум, или серебро
Аргентум, или серебро Установка по переработке углеводородов
Установка по переработке углеводородов Механизмы органических реакций. (Лекция 2)
Механизмы органических реакций. (Лекция 2) Азотная кислота и нитраты
Азотная кислота и нитраты Алюминий
Алюминий ВОДОРОД
ВОДОРОД Изомерия
Изомерия Сера и ее соединения
Сера и ее соединения Использование технологии уровневой дифференциации на уроках химии
Использование технологии уровневой дифференциации на уроках химии