Содержание
- 2. ЗАДАНИЕ 1. ОДНОКОМПОНЕНТНЫЕ СИСТЕМЫ. РАСЧЕТЫ С ИСПОЛЬЗОВАНИЕМ УРАВНЕНИЯ КЛАПЕЙРОНА-КЛАУЗИУСА На основании справочных данных из КС для
- 3. В качестве примера - трихлоруксусная кислота СCl3СООН Сначала - составить таблицу для построения зависимости P =
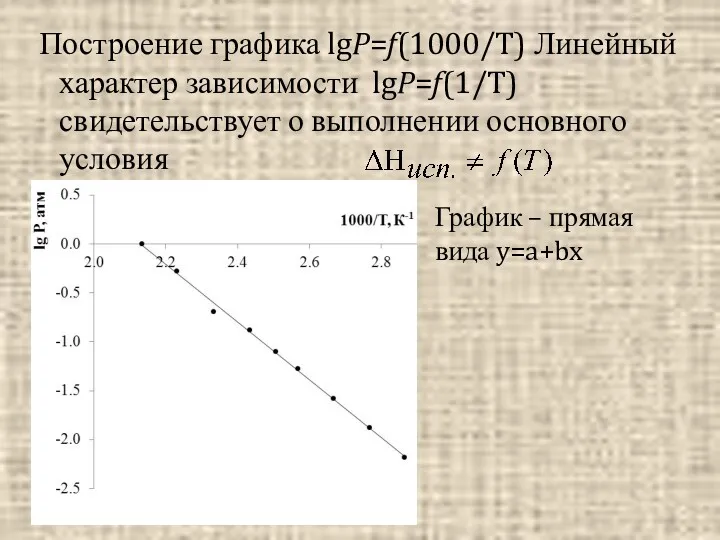
- 4. Построение графика lgP=f(1000/T) Линейный характер зависимости lgP=f(1/T) свидетельствует о выполнении основного условия График – прямая вида
- 5. Графически коэффициент В можно представить как тангенс угла наклона прямой к оси абсцисс. Он рассчитывается как
- 6. В этом выражении : A’ = const Отсюда находим теплоту испарения жидкости
- 7. После нахождения А и В становится известен вид температурной зависимости давления насыщенного пара для трихлоруксусной кислоты
- 8. Чтобы найти давление насыщенного пара при температуре t, подставляем нужную температуру в выражение lg P =
- 9. Теория растворов закон Рауля – при T = const парциальное давление насыщенного пара любого компонента идеального
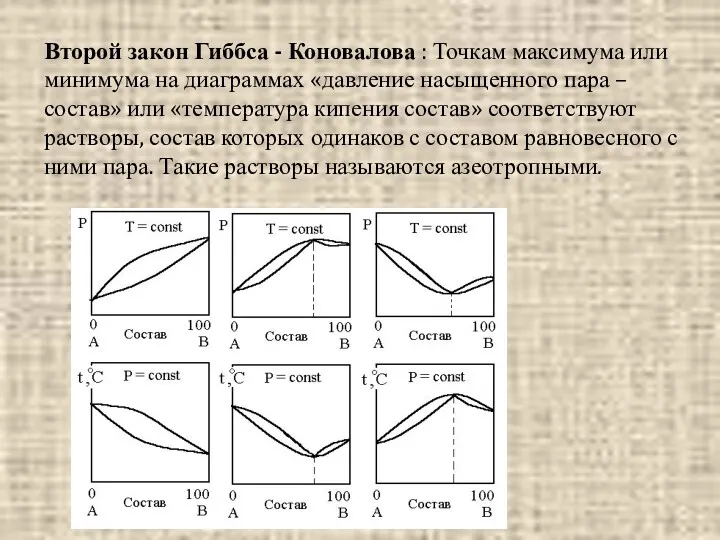
- 11. Второй закон Гиббса - Коновалова : Точкам максимума или минимума на диаграммах «давление насыщенного пара –
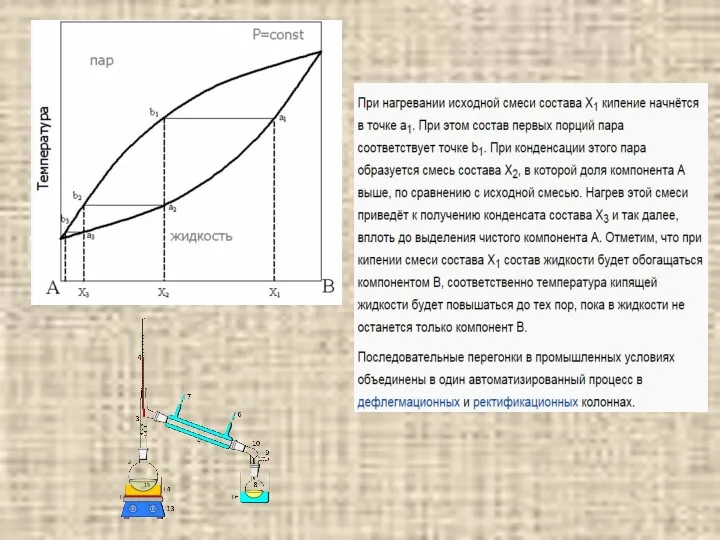
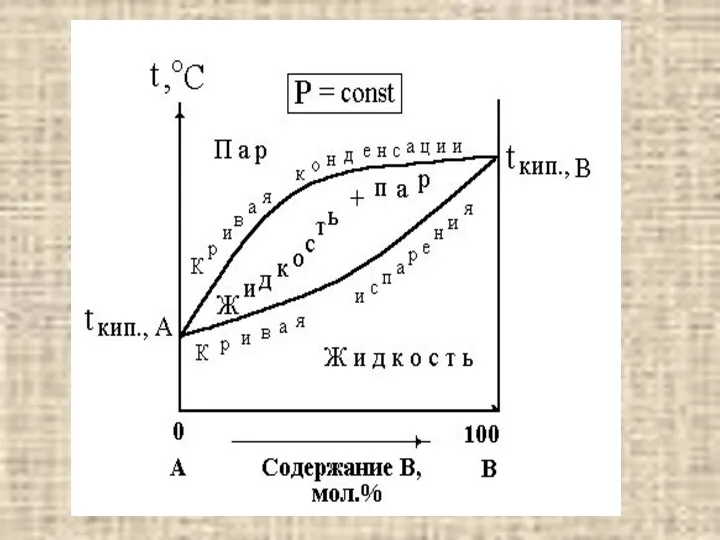
- 12. ЗАДАНИЕ 2. ДИАГРАММЫ «ТЕМПЕРАТУРА КИПЕНИЯ - СОСТАВ» Используя диаграммы «температура кипения – состав» при давлении Р
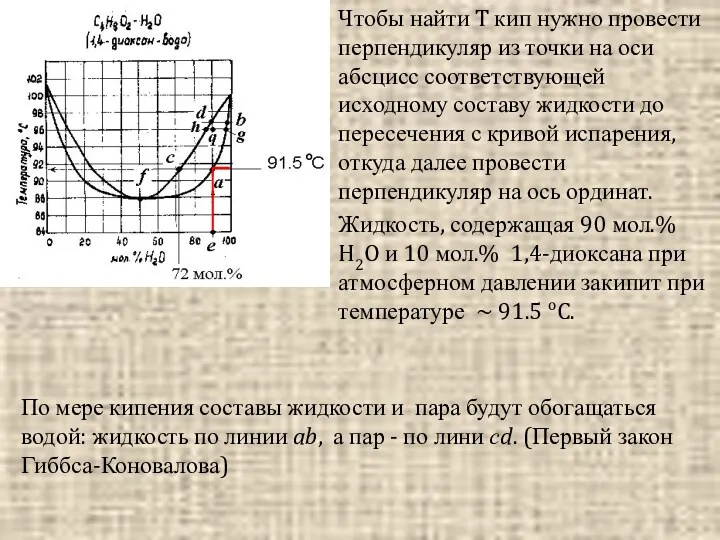
- 14. Чтобы найти T кип нужно провести перпендикуляр из точки на оси абсцисс соответствующей исходному составу жидкости
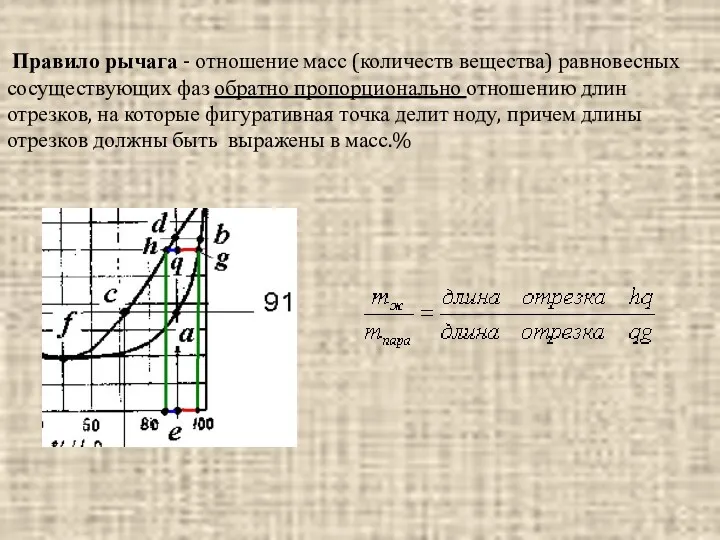
- 15. Правило рычага - отношение масс (количеств вещества) равновесных сосуществующих фаз обратно пропорционально отношению длин отрезков, на
- 16. ЗАДАНИЕ 3. ДИАГРАММЫ ПЛАВКОСТИ «ТЕМПЕРАТУРА ПЛАВЛЕНИЯ - СОСТАВ» Диаграмма плавкости двухкомпонентной системы веществ взаимно не растворимых
- 17. Диаграммы плавкости двухкомпонентной системы веществ неограниченно взаимно растворимых и в жидком, и в твёрдом состояниях Точка
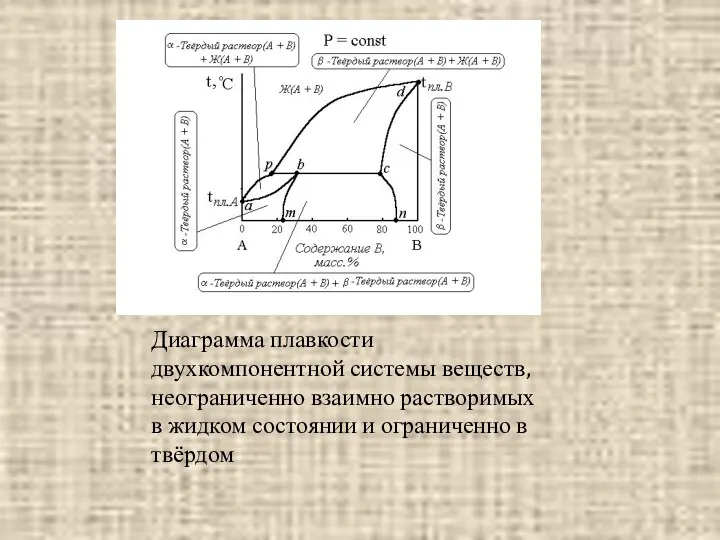
- 18. Диаграмма плавкости двухкомпонентной системы веществ, неограниченно взаимно растворимых в жидком состоянии и ограниченно в твёрдом
- 20. Скачать презентацию










 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей