Содержание
- 2. План работы: Исследование свойств различных веществ на электропроводность Классификация веществ по электропроводности Механизм диссоциации электролитов в
- 3. Помни, каждый ученик, Знай, любая кроха: Безопасность — хорошо, А халатность — плохо!
- 4. При работе с веществами не берите их … И не пробуйте на … , реактивы не
- 5. Чтобы опыт получился, Пользуйся посудой …!
- 6. Чай и вкусный бутерброд Очень просятся в твой ... Не обманывай себя – Есть и …
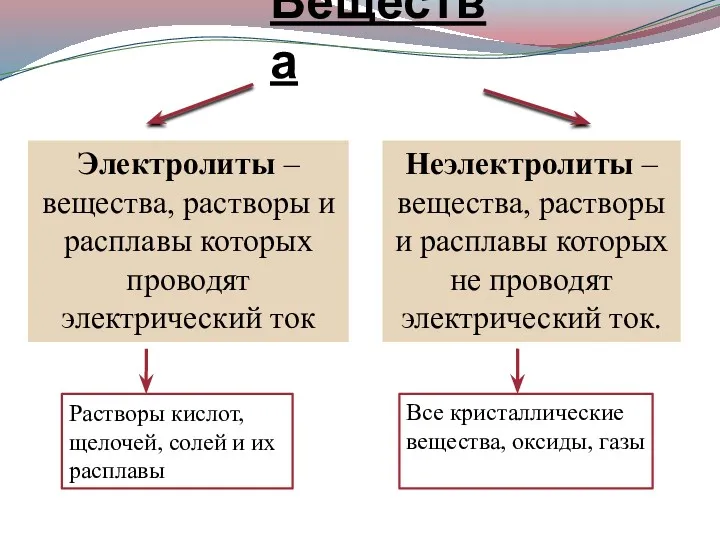
- 7. Вещества Неэлектролиты – вещества, растворы и расплавы которых не проводят электрический ток. Электролиты – вещества, растворы
- 8. Электролитическая диссоциация Сванте Аррениус (1859-1927) Процесс растворения или плавления электролитов сопровождается образованием заряженных частиц , способных
- 9. И. А. Каблуков (1857-1942) Процесс распада электролита на ионы при растворении его в воде или расплавлении
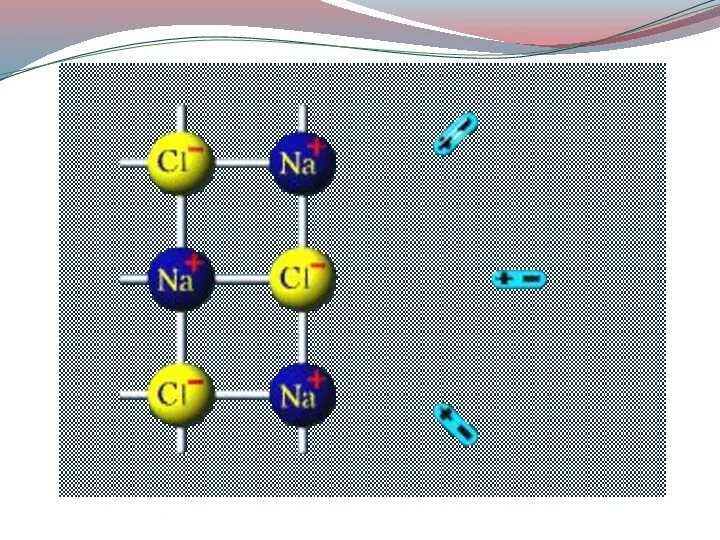
- 10. Строение молекулы воды Вода является полярной молекулой в виде диполи
- 11. Механизм электролитической диссоциации: Ориентация молекул – диполей воды около ионов; Гидратация (взаимодействие) молекул воды с противоположно
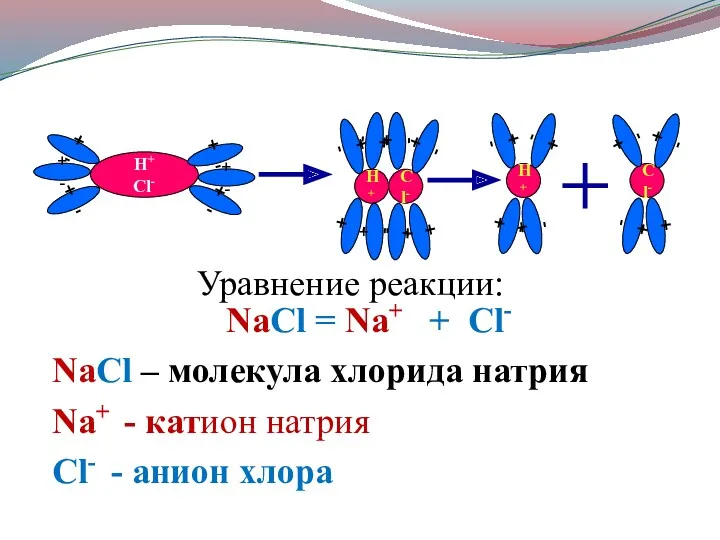
- 13. Уравнение реакции: NaCl = Na+ + Cl- NaCl – молекула хлорида натрия Na+ - катион натрия
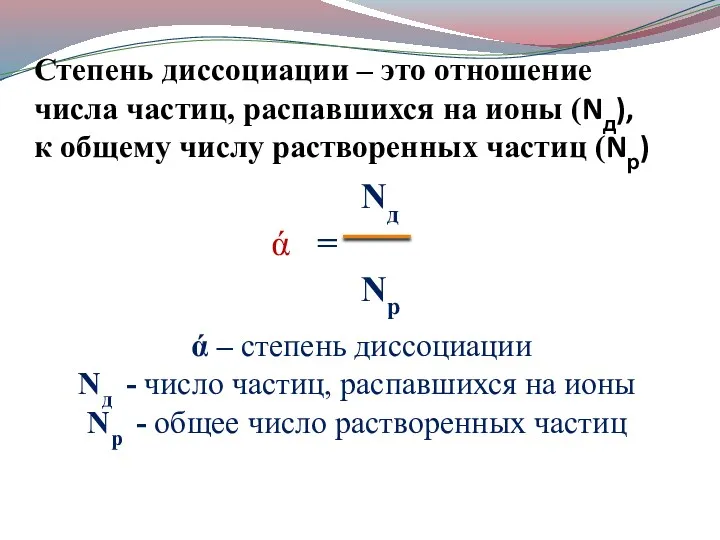
- 14. Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц
- 15. Степень диссоциации выражают в долях или процентах. При ά = 0 диссоциация отсутствует При ά =
- 16. Электролиты Сильные все растворимые соли; сильные кислоты H2SO4, HCl, HNO3 все щелочи NaOH, KOH Слабые слабые
- 17. Степень диссоциации зависит от: Природы вещества Концентрации раствора Температуры
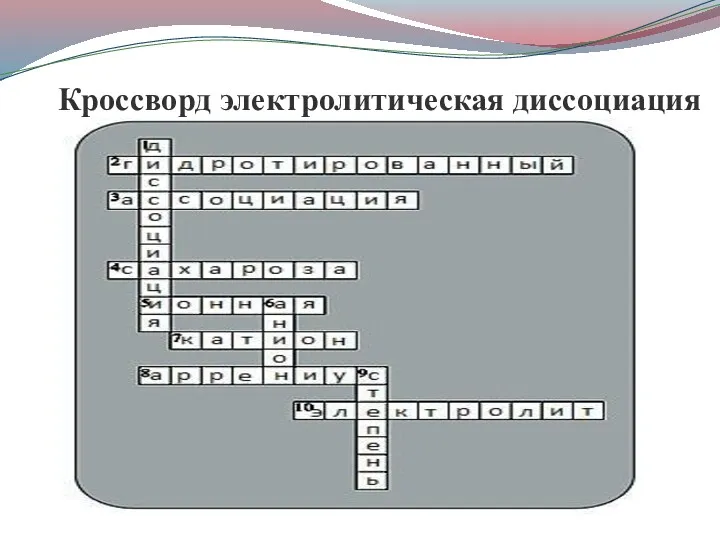
- 18. Кроссворд электролитическая диссоциация
- 20. Скачать презентацию












 Цикли трикарбонових кислот
Цикли трикарбонових кислот Разработка технологии получения раствора коагулянта в условиях филиала Азот АО ОХК УРАЛХИМ
Разработка технологии получения раствора коагулянта в условиях филиала Азот АО ОХК УРАЛХИМ The Sulphur cycle. The Sulphur dioxide problems
The Sulphur cycle. The Sulphur dioxide problems Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение История мыловарения. Моющее действие мыла
История мыловарения. Моющее действие мыла Молярная масса вещества
Молярная масса вещества Методы прямого секвенирования белков (пептидов)
Методы прямого секвенирования белков (пептидов) Органическая химия
Органическая химия Хроматографические методы, используемые в фармацевтическом анализе
Хроматографические методы, используемые в фармацевтическом анализе Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Технология производства сложных полиэфиров
Технология производства сложных полиэфиров Оценка химической обстановки при авариях на химически опасных объектах
Оценка химической обстановки при авариях на химически опасных объектах Строение и химические свойства кислот
Строение и химические свойства кислот Сложные эфиры. Жиры
Сложные эфиры. Жиры Таблица Менделеева
Таблица Менделеева Характеристика азота и фосфора. Свойства азота
Характеристика азота и фосфора. Свойства азота Классификация химических реакций
Классификация химических реакций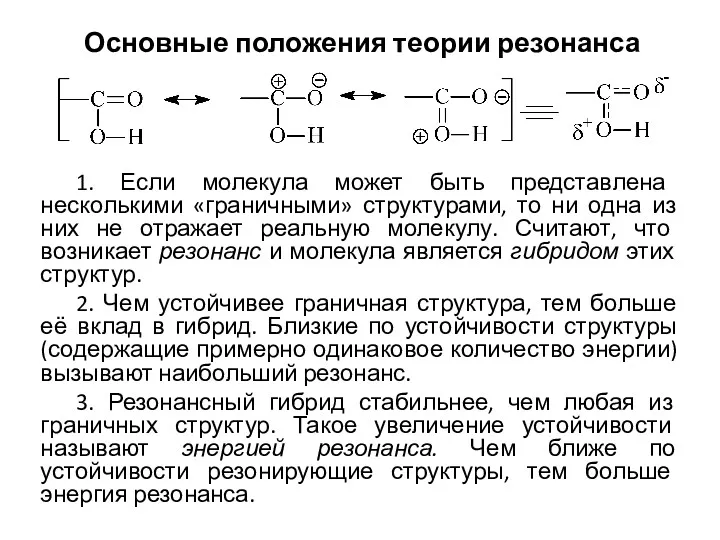 Основные положения теории резонанса
Основные положения теории резонанса Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Ионная связь
Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов. Ионная связь Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы Органическая химия. ДО. Глицерин как представитель многоатомных спиртов
Органическая химия. ДО. Глицерин как представитель многоатомных спиртов Соединения алюминия
Соединения алюминия Алюминий и его соединения
Алюминий и его соединения Ароматические соединения. Лекция 10
Ароматические соединения. Лекция 10 Кислоты и щелочи. Индикаторы. 6 класс
Кислоты и щелочи. Индикаторы. 6 класс