Содержание
- 2. Природа, по-видимому, любит превращения. И. Ньютон Эпиграф
- 3. – это процессы, в результате которых происходит преобразование одних веществ в другие. Химические реакции
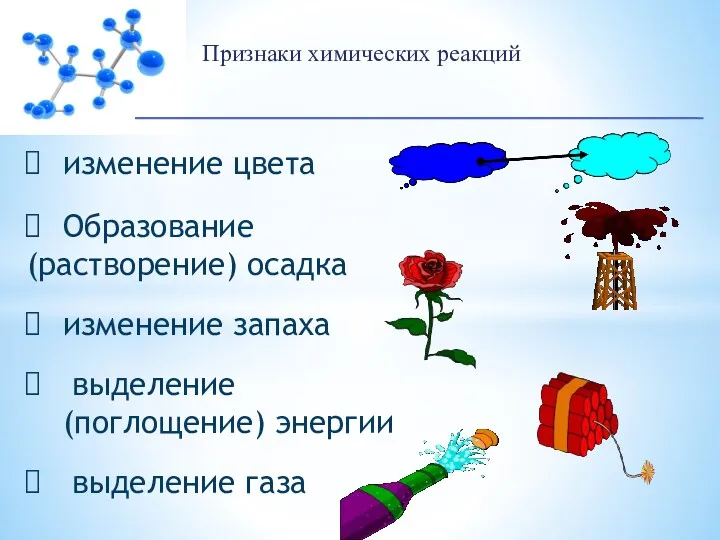
- 4. Признаки химических реакций изменение цвета Образование (растворение) осадка изменение запаха выделение (поглощение) энергии выделение газа
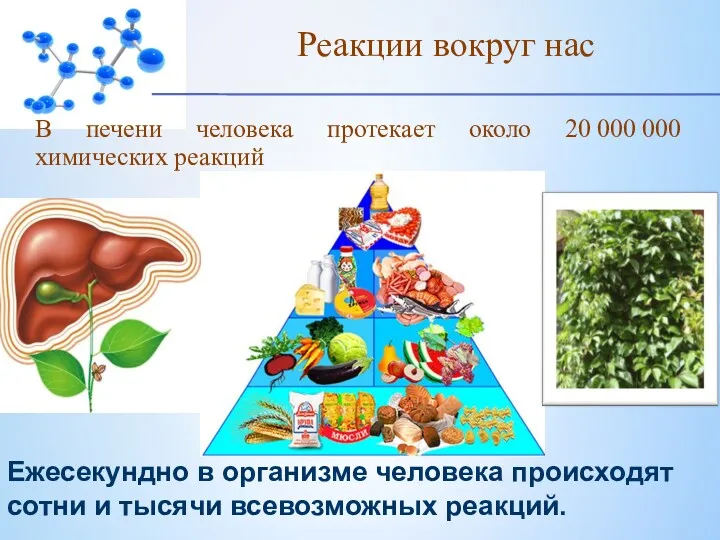
- 5. В печени человека протекает около 20 000 000 химических реакций . Реакции вокруг нас Ежесекундно в
- 6. По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По тепловому
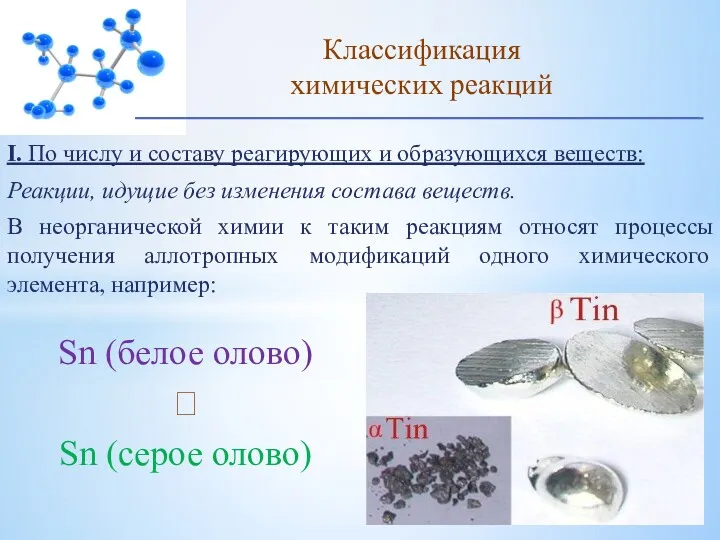
- 7. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие без изменения состава веществ. В
- 8. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества. Классификация
- 9. Классификация химических реакций Опыт «Горение серы в кислороде»
- 10. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 2.
- 11. Классификация химических реакций Опыт «Получение кислорода из перманганата калия»
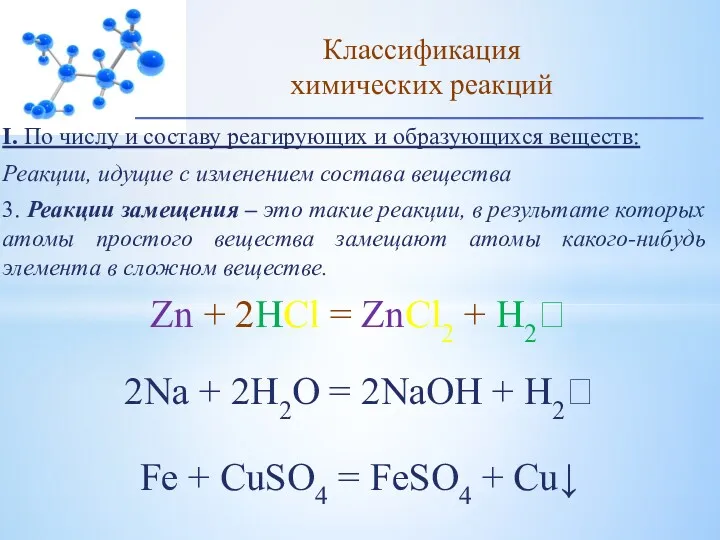
- 12. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 3.
- 13. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 4.
- 14. Классификация химических реакций Опыт «Получение аммиака из нашатыря»
- 15. Классификация химических реакций CuCl2 + Zn = Cu + ZnCl2 MgCO3 = MgO + CO2 KOH
- 16. Классификация химических реакций CuSO4 + Fe = FeSO4 + Cu↓ II. По изменению степеней окисления химических
- 17. 1. Экзотермические реакции протекают с выделением энергии: 4P + 5O2 = 2P2O5 + Q кДж Классификация
- 18. IV. По направлению: 1. Необратимые реакции протекают в данных условиях только в одном направлении: Классификация химических
- 19. V. По использованию катализатора: 1. Некаталитические реакции – реакции, идущие без участия катализатора: Классификация химических реакций
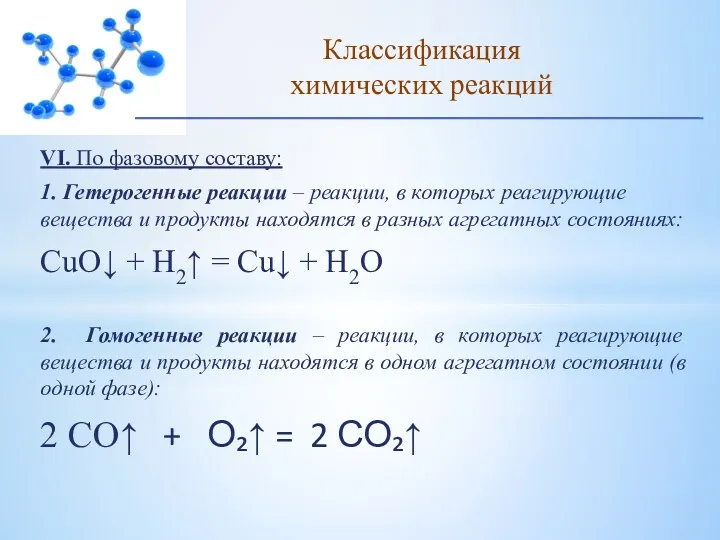
- 20. VI. По фазовому составу: 1. Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты находятся
- 21. Классификация химических реакций а) HCl(р-р) + KOH(р-р) =KCl(р-р) + H2O(ж) + Q б) 2H2(г) + O2(г)
- 22. Классификация химических реакций Домашнее задание § 24 № 5. Творческое задание
- 24. Скачать презентацию
















 Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Понятие о единичных и симметрично-равных направлениях
Понятие о единичных и симметрично-равных направлениях Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Галогенопроизводные. Растворимость, общие закономерности
Галогенопроизводные. Растворимость, общие закономерности Химический элемент медь
Химический элемент медь Aditivii alimentari: inofensivi sau poluanţi
Aditivii alimentari: inofensivi sau poluanţi Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас
Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас Сполуки нітрогену з оксигеном
Сполуки нітрогену з оксигеном Атом. Химический элемент. Изотопы. Простые и сложные вещества
Атом. Химический элемент. Изотопы. Простые и сложные вещества 20230330_zakony_termodinamiki_i_kinetika
20230330_zakony_termodinamiki_i_kinetika Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Производство ацетальдегида
Производство ацетальдегида Реакции ионного обмена
Реакции ионного обмена Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6
Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6 Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия
Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия Кремний
Кремний Главная подгруппа IV группы
Главная подгруппа IV группы Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Водород. Нахождение в природе. Физические и химические свойства. Применение
Водород. Нахождение в природе. Физические и химические свойства. Применение Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2)
Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2) Арены. Бензол
Арены. Бензол Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері
Пурин нуклеозидтері (аденозии 3-фосфор қышқылы, рибоксии). Сапасына Қойылантын талаптар, талдау әдістері Металлы. Классификация металлов
Металлы. Классификация металлов Качественные реакции на функциональные группы
Качественные реакции на функциональные группы Автомобильные пластичные смазки
Автомобильные пластичные смазки Синтез на основі бензену
Синтез на основі бензену Тяжелые металлы
Тяжелые металлы Практическая работа №2. Наблюдение за горящей свечой
Практическая работа №2. Наблюдение за горящей свечой