Содержание
- 2. Основные термодинамические характеристики .
- 3. 1.Внутренняя энергия.
- 4. 2.Первый закон термодинамики. Энтальпия.
- 5. 3. Второй закон термодинамики. Энтропия.
- 6. Третий закон термодинамики Энтропия идеального кристалла при абсолютном нуле равна нулю. (М. Планк,1911 г.)
- 7. ЗАКОН ГЕССА Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит
- 8. Энергия Гиббса (ΔG)
- 9. Тепловой эффект реакции. Закон Гесса
- 10. Термохимический закон Гесса (1841г) : Тепловой эффект химической реакции не зависит от пути её протекания, а
- 11. Пример
- 12. Следствия закона Гесса
- 13. Реакция эндотермическая
- 14. Рассчитайте тепловой эффект реакции: Ответ: - 1034, 0 кДж Реакция экзотермическая
- 15. Рассчитайте тепловой эффект реакции: Ответ: - 904, 8 кДж Реакция экзотермическая
- 16. ХИМИЧЕСКАЯ КИНЕТИКА ХИМИЧЕСКОЕ РАВНОВЕСИЕ и способы его смещения
- 17. Химическое равновесие Состояние равновесия характерно для обратимых химических реакций. Обратимая реакция - химическая реакция, которая при
- 18. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока
- 19. Смещение равновесия в нужном направлении достигается изменением условий реакции (принцип Ле-Шателье). Принцип Ле-Шателье -Если на систему,находящуюся
- 21. В закрытой системе в состоянии равновесия при постоянных температуре и давлении отношение произведений концентраций продуктов реакции
- 22. Константы равновесий в гомогенных и гетерогенных системах Гомогенная система N2(г) + 3H2(г) 2NH3(г) Гетерогенная система MgCO3(к)
- 23. Константа равновесия - мера глубины прохождения реакции Отсутствие взаимодействия Равновесие смещено в сторону прямой реакции Равновесие
- 24. Расчет равновесных концентраций реагентов по известным исходным концентрациям CO(г) + H2O(г) CO2(г) + H2(г) КС =
- 25. Определение возможного направления реакции при известном значении константы равновесия 2SO2(г) + O2(г) 2SO3(г) При Т =
- 26. Влияние температуры на смещение равновесия
- 27. Влияние температуры на смещение равновесия
- 28. Влияние концентрации на смещение равновесия Катализаторы не влияют на положение равновесия!
- 29. Влияние давления на смещение равновесия Влияние давления на состояние равновесия проявляется только при наличии в системе
- 30. Влияние различных факторов на состояние химического равновесия. Принцип Ле Шателье Если на систему, находящуюся в равновесии,
- 31. Изменение концентраций (парциальных давлений) веществ Влияние концентраций (парциальных давлений) компонентов системы увеличение концентрации продуктов реакции или
- 32. Влияние концентраций веществ на состояние равновесия системы CH4(г) + 2H2O(г) CO2(г) + 4H2(г) Увеличение концентрации CH4
- 33. Влияние общего давления в системе Давление оказывает влияние на равновесие реакций, сопровождающихся изменением количеств газообразных веществ
- 34. Влияние температуры на состояние равновесия Нагревание смещение равновесия в сторону эндотермических реакций Охлаждение смещение равновесия в
- 35. В какую сторону сместится равновесие?
- 36. Концентрацию, каких веществ надо увеличить, чтобы сместить равновесие 2NO + Cl2 = 2NOCl + Q влево?
- 38. Скачать презентацию



































 Месторождения берилла и топаза
Месторождения берилла и топаза Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Metode electrochimice. Generalităţi
Metode electrochimice. Generalităţi Соединения железа
Соединения железа Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Методика преподавания химии
Методика преподавания химии Высшие жирные кислоты. Липиды
Высшие жирные кислоты. Липиды Электронные конфигурации атомов
Электронные конфигурации атомов Метод молекулярных орбиталей
Метод молекулярных орбиталей Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы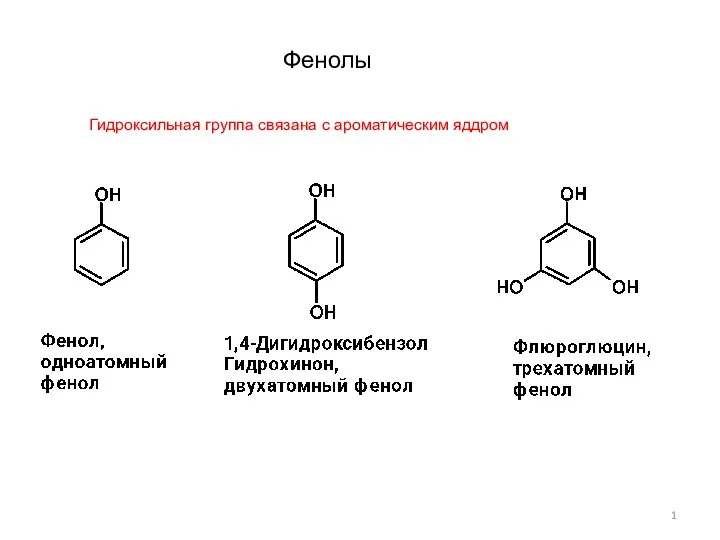 Фенолы-1
Фенолы-1 Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Естери. Класифікація та номенклатура естерів
Естери. Класифікація та номенклатура естерів Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Сложные эфиры
Сложные эфиры Основні класи неорганічних сполук
Основні класи неорганічних сполук Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Производство полимеров
Производство полимеров Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы
Элементтер-органогендер. өмір металдары. Көміртек – органикалық қосылыстардың негізін құраушы Гетероциклические соединения
Гетероциклические соединения Свойства воды. Оценка качества
Свойства воды. Оценка качества Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою ОВР – окислительно-восстановительные реакции. Тема 4
ОВР – окислительно-восстановительные реакции. Тема 4 Solutions and solubilities
Solutions and solubilities Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Генетическая связь между основными классами неорганических веществ
Генетическая связь между основными классами неорганических веществ