Слайд 2

ОВР – окислительно-восстановительные реакции
Это реакции, которые происходят с изменением степени окисления
(СО) реагирующих веществ
Слайд 3

В процессе ОВР восстановитель - отдаёт электроны, то есть окисляется;
окислитель присоединяет
электроны, то есть восстанавливается.
Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно.
Окисление — процесс отдачи электронов, с увеличением степени окисления.
Восстановление - процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
Слайд 4
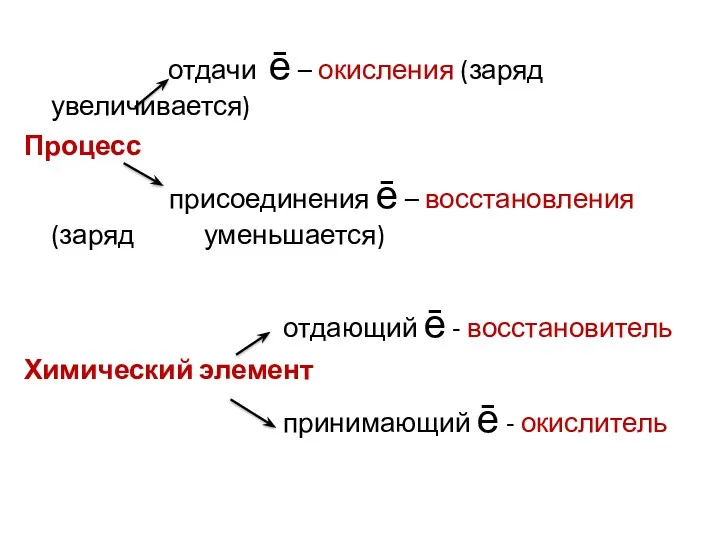
отдачи ē – окисления (заряд увеличивается)
Процесс
присоединения ē –
восстановления (заряд уменьшается)
отдающий ē - восстановитель
Химический элемент
принимающий ē - окислитель
Слайд 5

Процесс окисления (ок-я);
Химический элемент – восстановитель (в-ль);
Процесс восстановления (в-ния);
Химический элемент –
окислитель (ок-ль)
Слайд 6

В ОВР электроны от одних атомов, молекул или ионов переходят к
другим.
Процесс отдачи электронов — окисление.
При этом степень окисления повышается:
H20 - 2ē →
H20 - 2ē →2H+
S2- - 2ē →
S2- - 2ē → S0
Al0 - 3ē →
Al0 - 3ē → Al3+
Fe2+ - ē →
Fe2+ - ē → Fe3+
Слайд 7

Процесс присоединения электронов — восстановление.
При восстановлении степень окисления понижается:
O20 + 4ē
→
O20 + 4ē → 2O2-
Mn7+ + 5ē →
Mn7+ + 5ē → Mn2+
Mn4+ + 2ē →
Mn4+ + 2ē → Mn2+
Cr6+ + 6ē →
Cr6+ + 6ē → Cr0
Слайд 8

Окислительно-восстановительная реакция между водородом и фтором
H20 + F20 → 2H+F-
Разделяется на две:
1) Окисление:
H20
- 2ē → 2H+ восстановитель (в-ль)
2) Восстановление:
F20 + 2ē → 2 F- окислитель (ок-ль)
Слайд 9

Задание для студентов
1. Укажите окислитель или восстановитель:
S2- →S0 ……
Mg2+
→Mg0,
N5+ →N3-,
Р0 →P5+,
Al3+ →Al0.
Слайд 10

2. Определите степень окисления серы в следующих соединениях:
SO2, SO3, MgSO4, H2S,
H2SO4, H2SO3, K2S2O8
Определите степень окисления азота в следующих соединениях:
NH3, N2O5, NO, N2O, KNO2, Ca(NO3)2
Слайд 11

Al + O2 = Al2O3
Al0 + O02 = Al2+3O3-2
Алюминий отдает электроны (приобретает положительную
степень окисления),
а кислород – принимает электроны (приобретает отрицательную степень окисления).
Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона.
Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
Al0 - 3ē → Al3+
O20 + 4ē → 2O2-
Слайд 12

Al0 - 3ē → Al3+ 4
O20 + 4ē → 2O2- 3
Чтобы количество отданных
и принятых электронов выровнялось,
первое уравнение надо умножить на 4,
а второе – на 3.
Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
4Al + 3O2 = 2Al2O3
Слайд 13

Задания для студентов:
1. Ознакомьтесь с формой написания ОВР
2. Расставьте коэффициенты
в ОВР методом электронного баланса.
Число ē отданных восстановителем = числу ē принятых окислителем.
Слайд 14
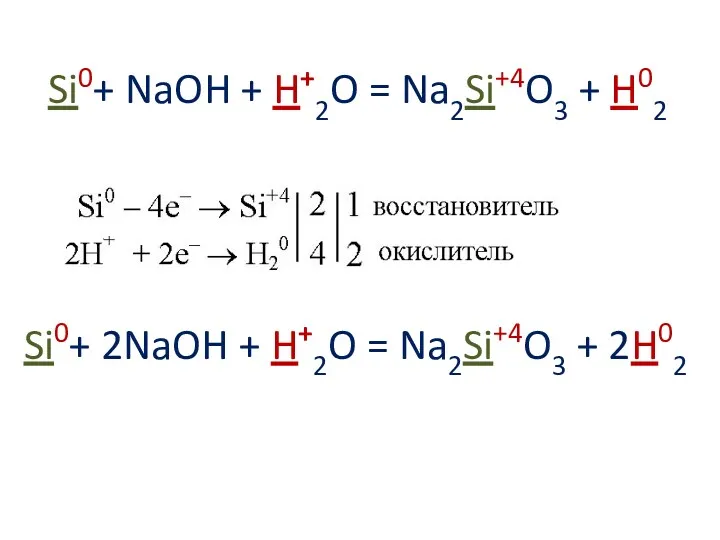
Si0+ NaOH + H+2O = Na2Si+4O3 + H02
Si0+ 2NaOH + H+2O
= Na2Si+4O3 + 2H02
Слайд 15
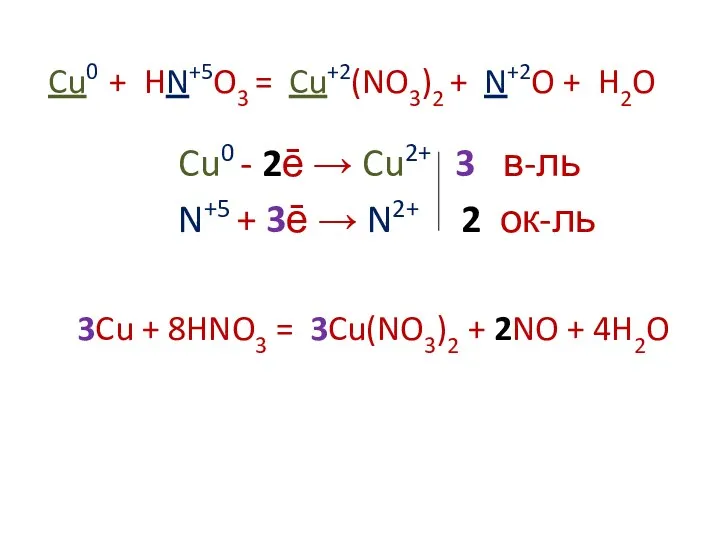
Cu0 + HN+5O3 = Cu+2(NO3)2 + N+2O + H2O
Cu0 -
2ē → Cu2+ 3 в-ль
N+5 + 3ē → N2+ 2 ок-ль
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
Слайд 16
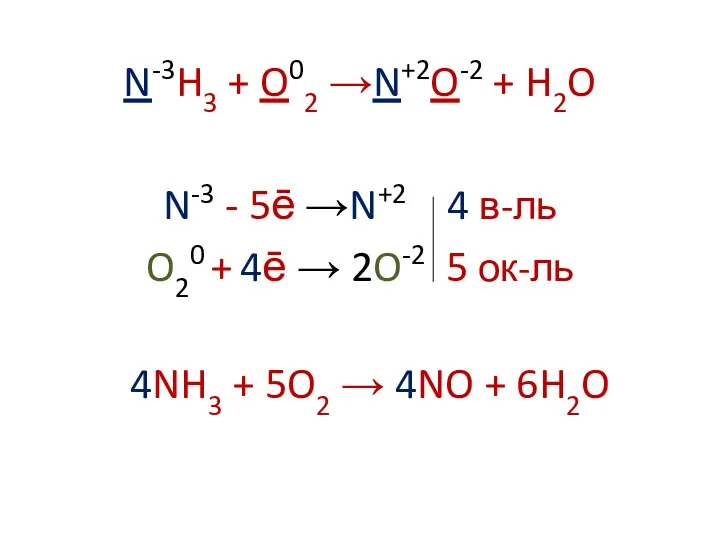
N-3H3 + O02 →N+2O-2 + H2O
N-3 - 5ē →N+2 4 в-ль
O20
+ 4ē → 2O-2 5 ок-ль
4NH3 + 5O2 → 4NO + 6H2O
Слайд 17
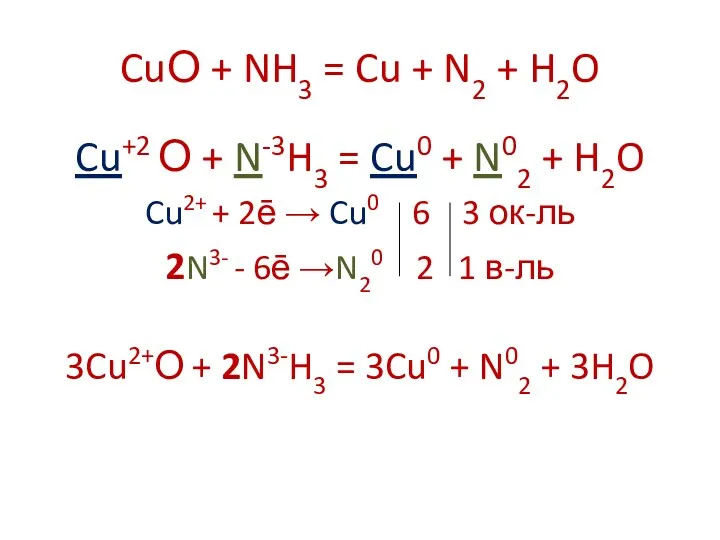
CuО + NH3 = Cu + N2 + H2O
Cu+2 О +
N-3H3 = Cu0 + N02 + H2O
Cu2+ + 2ē → Cu0 6 3 ок-ль
2N3- - 6ē →N20 2 1 в-ль
3Cu2+О + 2N3-H3 = 3Cu0 + N02 + 3H2O
Слайд 18

Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель в:
реакциях окисления;
реакциях
взаимодействия металлов с кислотами.
Слайд 19
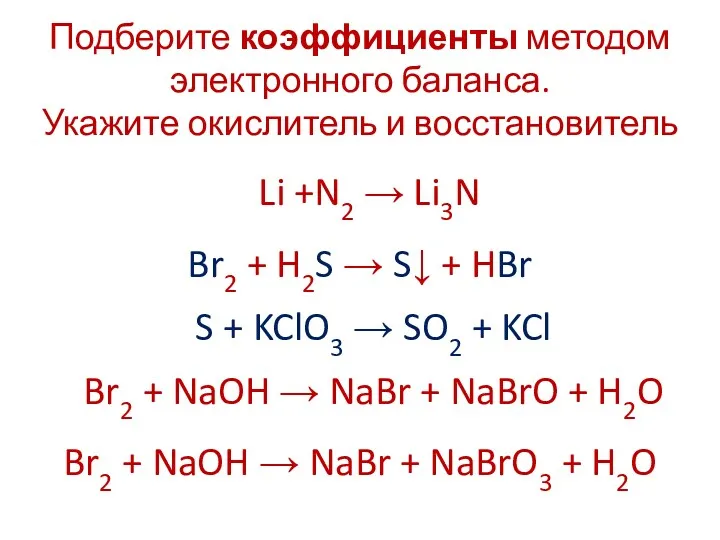
Подберите коэффициенты методом электронного баланса.
Укажите окислитель и восстановитель
Li +N2
→ Li3N
Br2 + H2S → S↓ + HBr
S + KClO3 → SO2 + KCl
Br2 + NaOH → NaBr + NaBrO + H2O
Br2 + NaOH → NaBr + NaBrO3 + H2O
Слайд 20
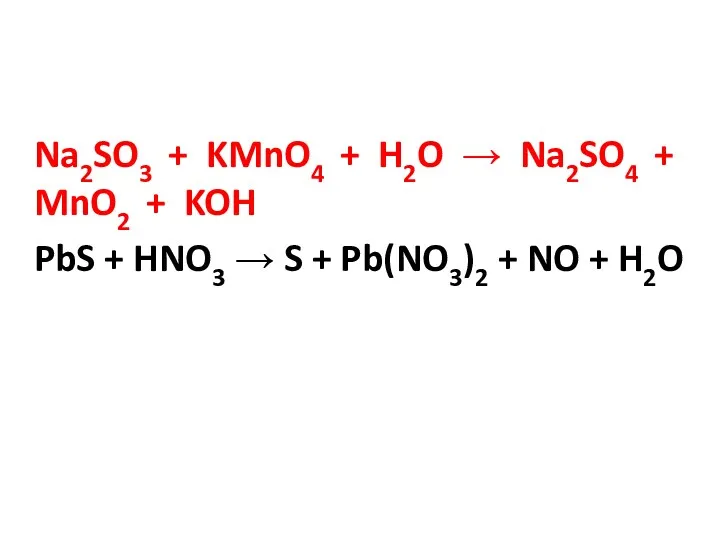
Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
PbS
+ HNO3 → S + Pb(NO3)2 + NO + H2O
Слайд 21
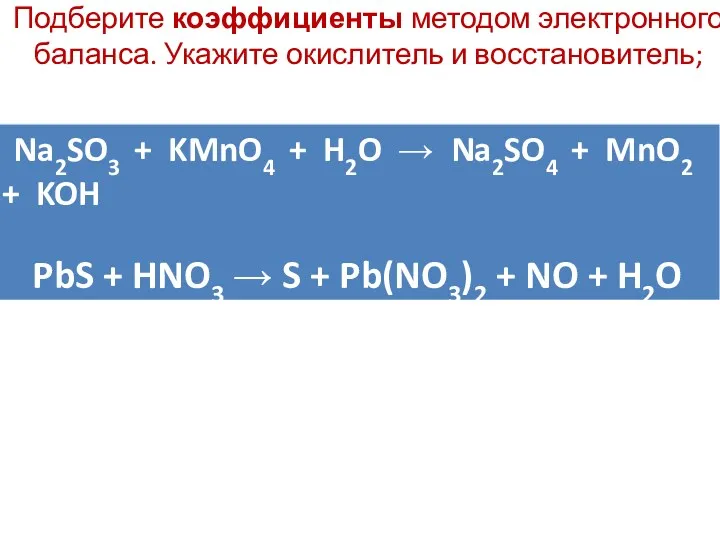
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель;
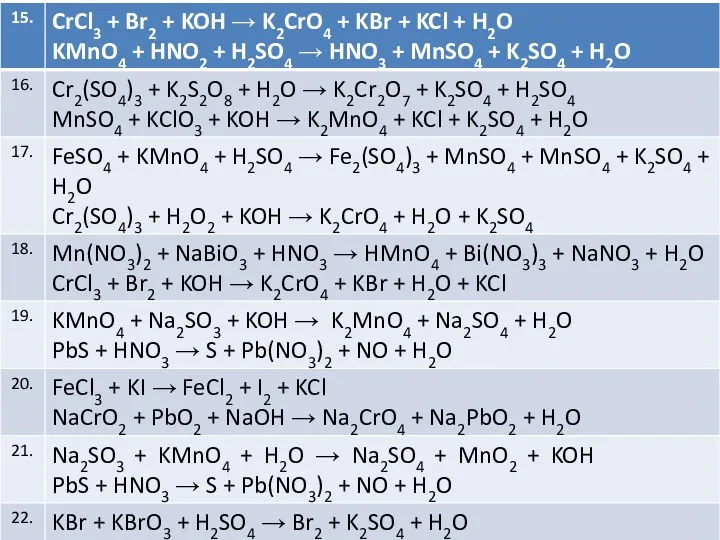
Слайд 22
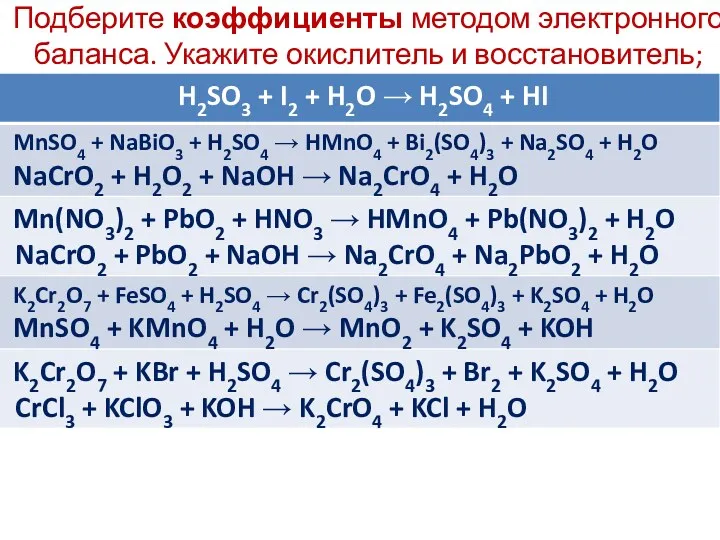
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель;
Слайд 23

Слайд 24
Слайд 25
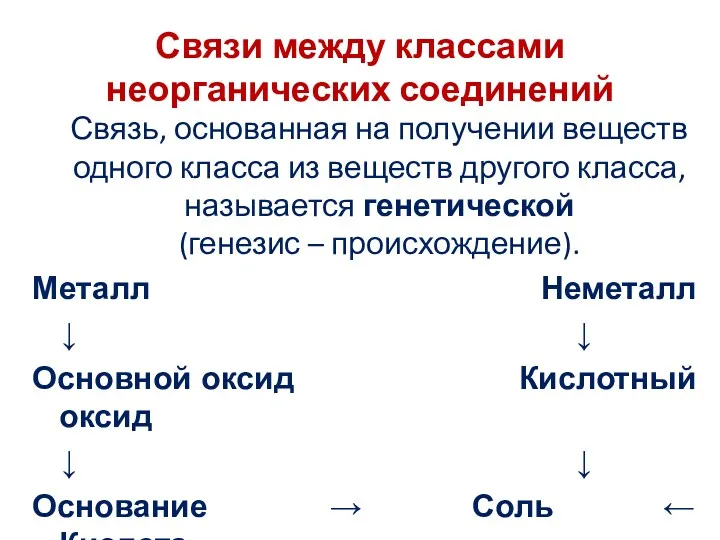
Связи между классами неорганических соединений
Связь, основанная на получении веществ одного класса
из веществ другого класса, называется генетической (генезис – происхождение).
Металл Неметалл
↓ ↓
Основной оксид Кислотный оксид
↓ ↓
Основание → Соль ← Кислота
Слайд 26












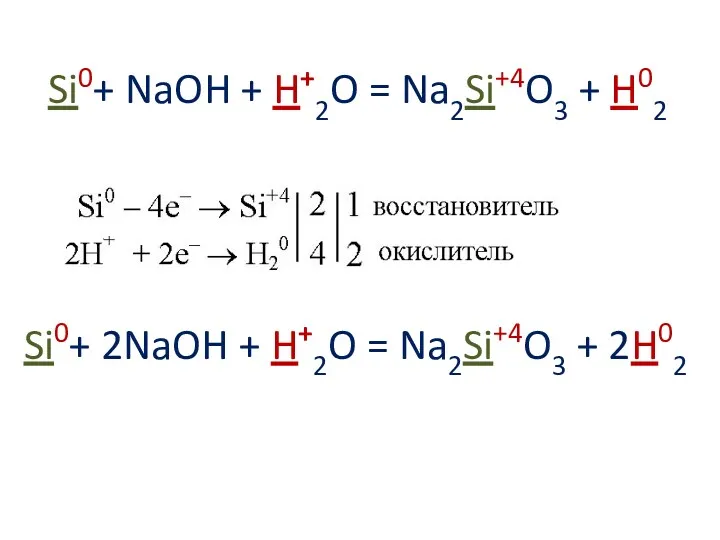












 Кислород. Распространение кислорода в природе (8 класс)
Кислород. Распространение кислорода в природе (8 класс) Электролиз веществ
Электролиз веществ Основные понятия и законы химии. Тема1
Основные понятия и законы химии. Тема1 Карбоновые кислоты
Карбоновые кислоты Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Характер затвердевания
Характер затвердевания Взаимодействия кислорода с металлом
Взаимодействия кислорода с металлом Радиоактивные элементы почв
Радиоактивные элементы почв Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Металлы применяемые в строительстве
Металлы применяемые в строительстве Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы ЭЛЕКТРОЛИТЫ
ЭЛЕКТРОЛИТЫ Составление формул молекулярных простых веществ
Составление формул молекулярных простых веществ МЕТОДЫ ОЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ
МЕТОДЫ ОЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Кислотность и основность органических соединений. (Лекция 3)
Кислотность и основность органических соединений. (Лекция 3) Валентность химических элементов
Валентность химических элементов Составление химических формул бинарных соединений по степени окисления атомов
Составление химических формул бинарных соединений по степени окисления атомов Electroanalytical Chemistry
Electroanalytical Chemistry Кристаллохимия как наука
Кристаллохимия как наука IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)
IVA группа С, Si, Ge, Sn, Pb (подгруппа титана) Параметры токсичности продуктов горения материала. (Задача 3)
Параметры токсичности продуктов горения материала. (Задача 3) Природный и попутный нефтяной газы
Природный и попутный нефтяной газы