Содержание
- 3. 1 пикометр = 0.001 нанометров 1 нм = 10-9 м
- 5. АЛМАЗ ГРАФИТ ФУЛЛЕРЕН
- 7. ПРИМЕНЕНИЕ УГЛЕРОДА
- 10. Противоморозная добавка в антигололедных реагентах Антикоррозионный реагент
- 11. КАРБОНИЛЫ СО – лиганд в комплексных соединениях Задача 5. Используя метод валентных связей (ВС), установить простран-
- 12. 1. При образовании тетракарбонила никеля под влиянием лиганда СО про- исходит переход 4 s-электронов на 3d-орбитали
- 13. При нормальных условиях — бесцветный газ с запахом прелого сена. Использовался в Первую мировую войну как
- 14. 2Мg + CO2 = 2MgO + C
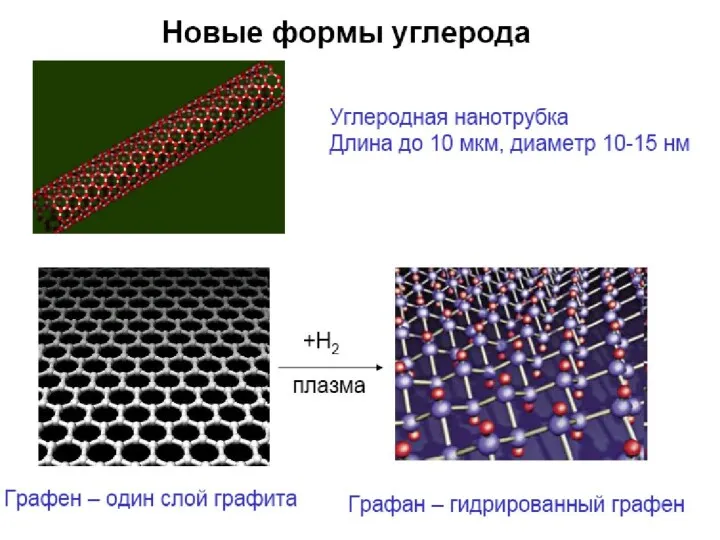
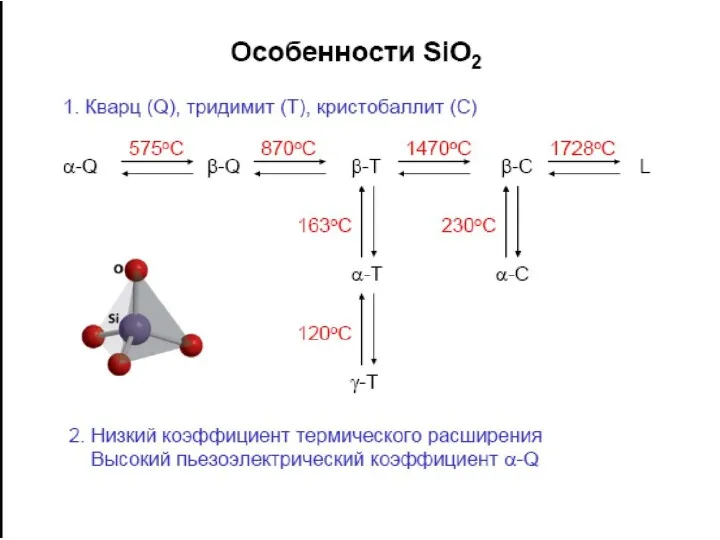
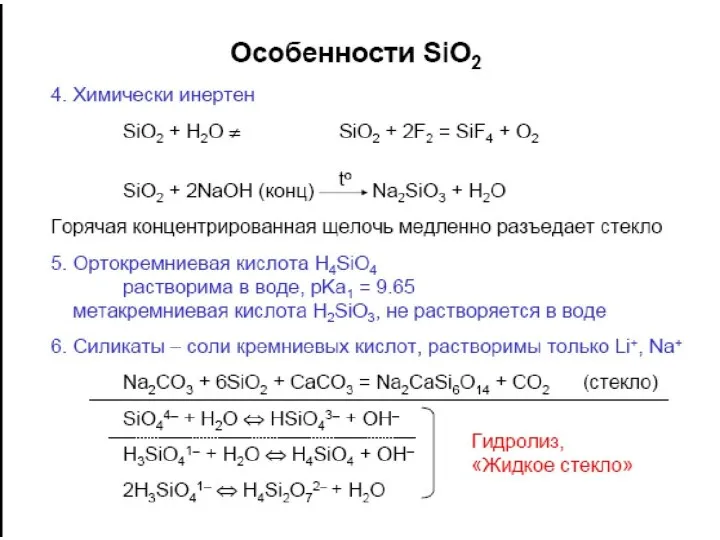
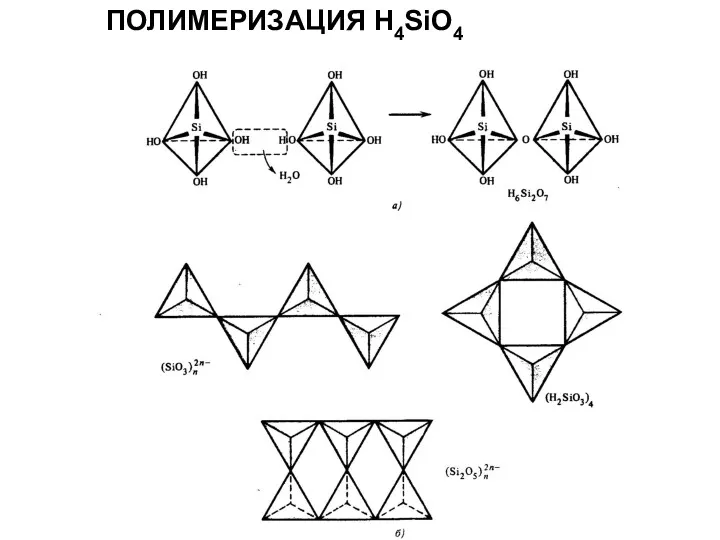
- 19. ПОЛИМЕРИЗАЦИЯ Н4SiO4
- 21. Скачать презентацию
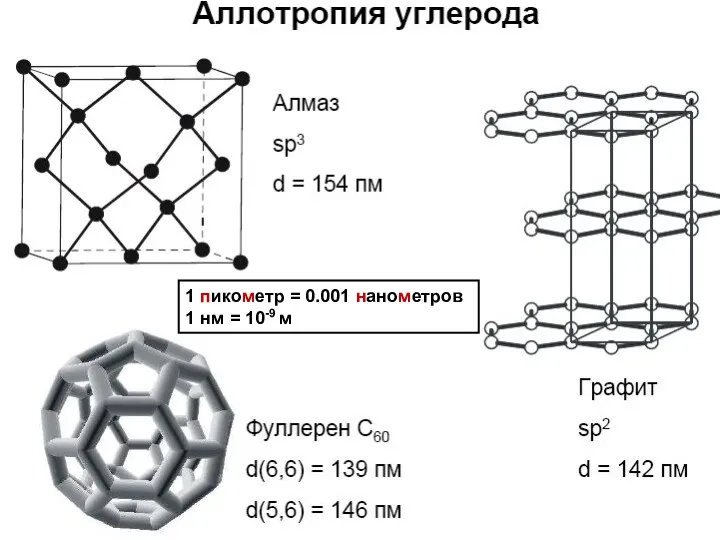
1 пикометр = 0.001 нанометров
1 нм = 10-9 м
1 пикометр = 0.001 нанометров
1 нм = 10-9 м
АЛМАЗ
ГРАФИТ
ФУЛЛЕРЕН
АЛМАЗ
ГРАФИТ
ФУЛЛЕРЕН
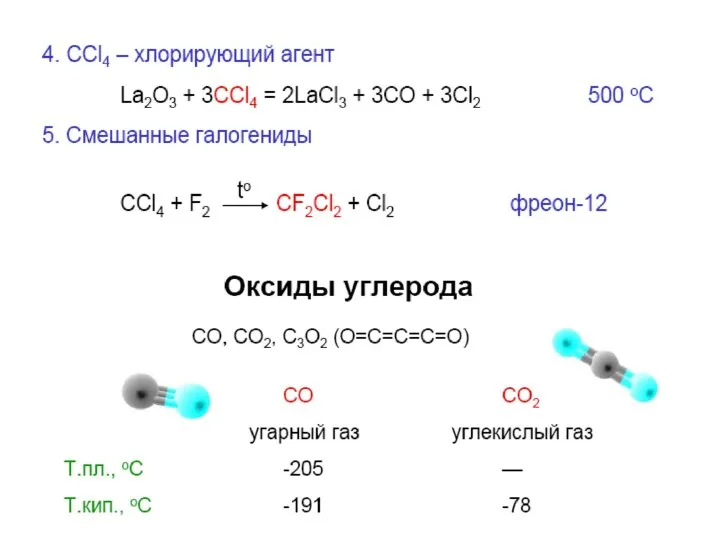
ПРИМЕНЕНИЕ УГЛЕРОДА
ПРИМЕНЕНИЕ УГЛЕРОДА
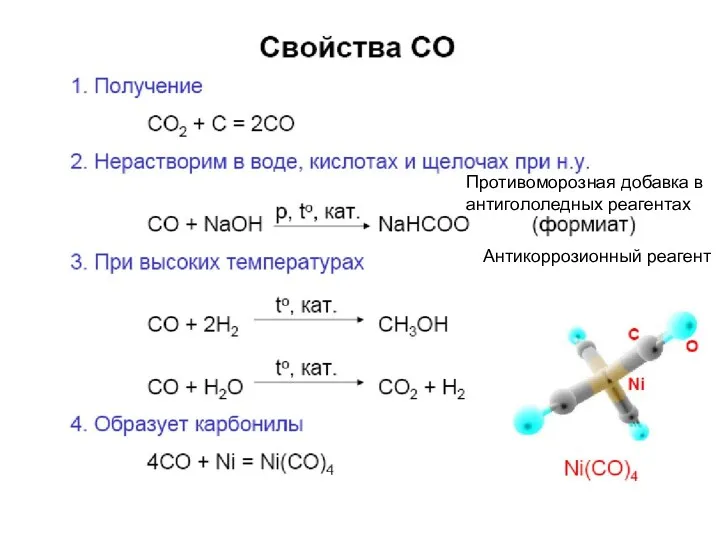
Противоморозная добавка в антигололедных реагентах
Антикоррозионный реагент
Противоморозная добавка в антигололедных реагентах
Антикоррозионный реагент
КАРБОНИЛЫ
СО – лиганд в комплексных соединениях
Задача 5.
Используя метод валентных связей (ВС),
КАРБОНИЛЫ
СО – лиганд в комплексных соединениях
Задача 5.
Используя метод валентных связей (ВС),
ственную конфигурацию тетракарбонила никеля [Ni(CO)
4
].
Решение.
Метод ВС образование комплексных соединений объясняет до-
норно-акцепторным взаимодействием комплексообразователя (акцептор) и ли-
гандов (доноры).
Карбонил никеля образуется в результате взаимодействия атомов никеля
(степень окисления никеля равна нулю) и молекул монооксида углерода: Ni +
4CO = [Ni(CO)
4
].
Электронная конфигурация атома никеля и схема распределения валент-
ных электронов по атомным орбиталям
Задача 5.
Используя метод валентных связей (ВС), установить простран-
ственную конфигурацию тетракарбонила никеля [Ni(CO)
4
].
Решение.
Метод ВС образование комплексных соединений объясняет до-
норно-акцепторным взаимодействием комплексообразователя (акцептор) и ли-
гандов (доноры).
Карбонил никеля образуется в результате взаимодействия атомов никеля
(степень окисления никеля равна нулю) и молекул монооксида углерода: Ni +
4CO = [Ni(CO)
4
].
Электронная конфигурация атома никеля и схема распределения валент-
ных электронов по атомным орбиталям
Задача
Используя метод валентных связей (ВС), установить простран
ственную конфигурацию тетракарбонила никеля [Ni(CO)4].
Решение.
Метод ВС образование комплексных соединений объясняет донорно-акцепторным взаимодействием комплексообразователя (акцептор) и лигандов (доноры).
Тетракарбонил никеля образуется в результате взаимодействия атомов Ni(0) – комплексообразователь и молекул монооксида углерода CO – лиганд:
Ni + 4CO = [Ni(CO)4].
Электронная конфигурация атома никеля и схема распределения валентных электронов по атомным орбиталям:
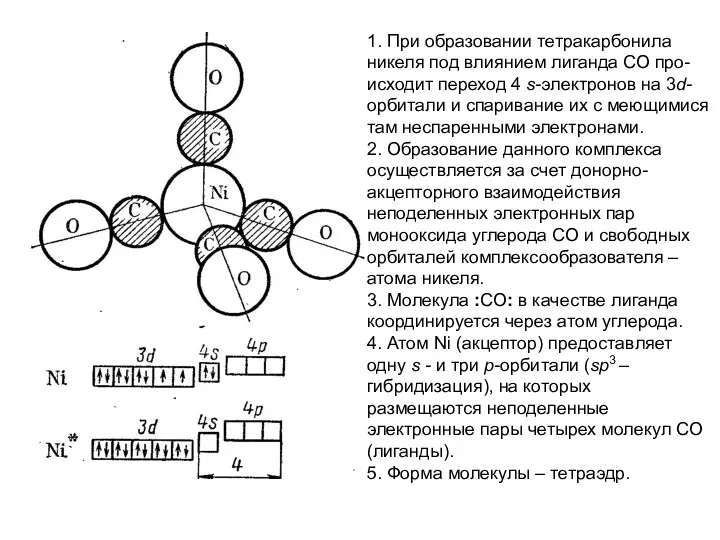
1. При образовании тетракарбонила никеля под влиянием лиганда СО про-
исходит переход
1. При образовании тетракарбонила никеля под влиянием лиганда СО про-
исходит переход
2. Образование данного комплекса осуществляется за счет донорно-
акцепторного взаимодействия неподеленных электронных пар монооксида углерода СО и свободных орбиталей комплексообразователя – атома никеля.
3. Молекула :СО: в качестве лиганда координируется через атом углерода.
4. Атом Ni (акцептор) предоставляет одну s - и три р-орбитали (sp3 – гибридизация), на которых размещаются неподеленные электронные пары четырех молекул СО(лиганды).
5. Форма молекулы – тетраэдр.
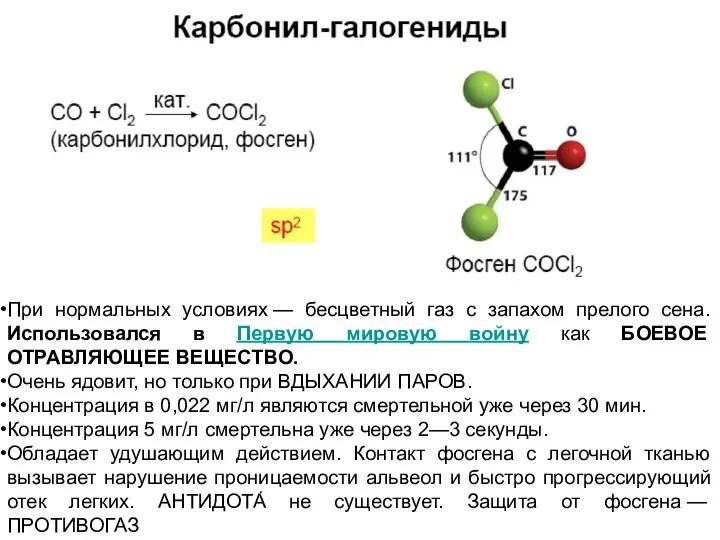
При нормальных условиях — бесцветный газ с запахом прелого сена. Использовался в
При нормальных условиях — бесцветный газ с запахом прелого сена. Использовался в
Очень ядовит, но только при ВДЫХАНИИ ПАРОВ.
Концентрация в 0,022 мг/л являются смертельной уже через 30 мин.
Концентрация 5 мг/л смертельна уже через 2—3 секунды.
Обладает удушающим действием. Контакт фосгена с легочной тканью вызывает нарушение проницаемости альвеол и быстро прогрессирующий отек легких. АНТИДОТА не существует. Защита от фосгена — ПРОТИВОГАЗ
.
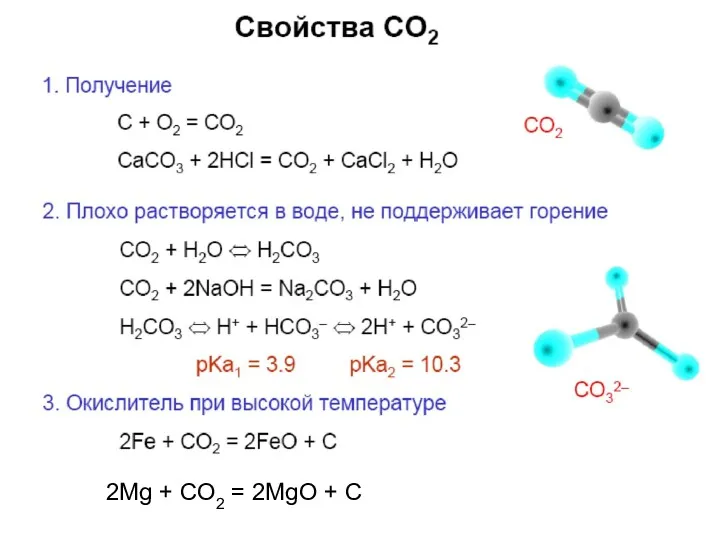
2Мg + CO2 = 2MgO + C
2Мg + CO2 = 2MgO + C
ПОЛИМЕРИЗАЦИЯ Н4SiO4
ПОЛИМЕРИЗАЦИЯ Н4SiO4







 Выдающиеся открытия в области химии
Выдающиеся открытия в области химии Жесткость воды. Способы ее устранения
Жесткость воды. Способы ее устранения Характеристика s,p,d,f - элементов
Характеристика s,p,d,f - элементов Растворы неэлектролитов и электролитов
Растворы неэлектролитов и электролитов Protein and amino acid metabolism
Protein and amino acid metabolism Понятие об алкинах
Понятие об алкинах Углеводородное топливо, его виды и назначения
Углеводородное топливо, его виды и назначения Спирты. Классификация спиртов
Спирты. Классификация спиртов Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Аммиак
Аммиак Растворы и растворители
Растворы и растворители Простые вещества — металлы и неметаллы
Простые вещества — металлы и неметаллы Полипропилен
Полипропилен Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Основные понятия органической химии
Основные понятия органической химии Природный газ и нефть
Природный газ и нефть Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Аммиак. Состав. Строение
Аммиак. Состав. Строение Химическая связь
Химическая связь Общие способы получения металлов
Общие способы получения металлов Алкадиены
Алкадиены Титрование в неводных средах. (Лекция 26)
Титрование в неводных средах. (Лекция 26) Ионная хроматография
Ионная хроматография Хімічний зв'язок
Хімічний зв'язок Неметаллические материалы
Неметаллические материалы Гидролиз солей
Гидролиз солей Елементи VІ групи головної підгрупи
Елементи VІ групи головної підгрупи Химические опасности. Нитраты
Химические опасности. Нитраты