Содержание
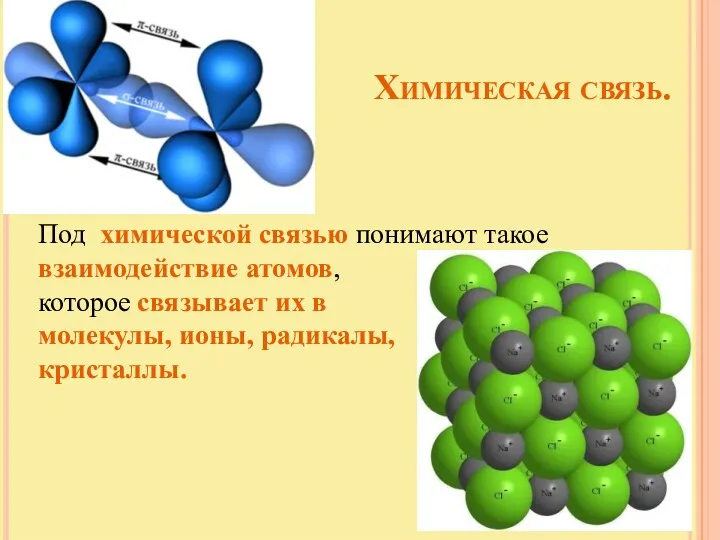
- 2. Химическая связь. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы,
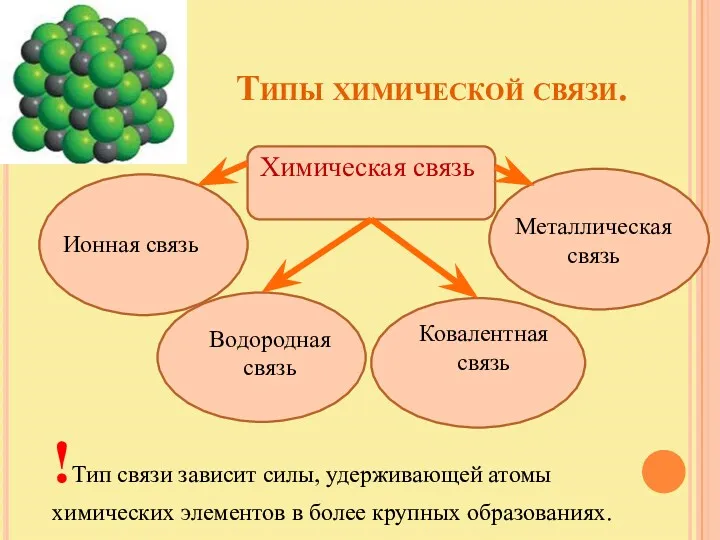
- 3. Типы химической связи. Химическая связь Ионная связь Металлическая связь Водородная связь Ковалентная связь !Тип связи зависит
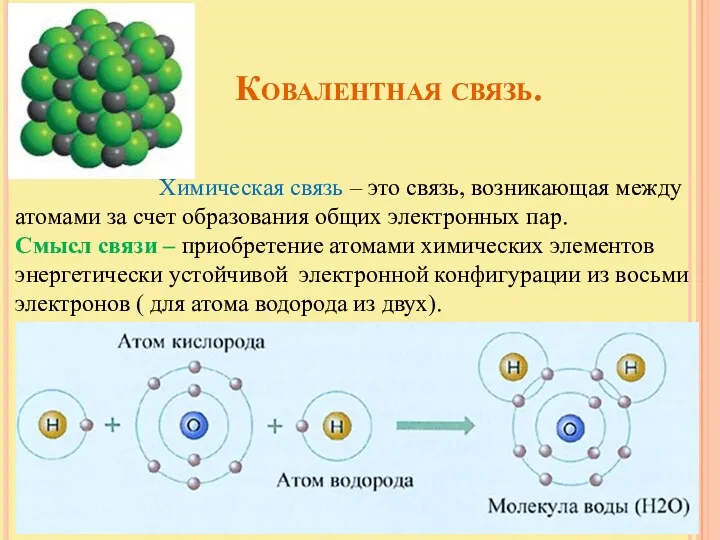
- 4. Ковалентная связь. Химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
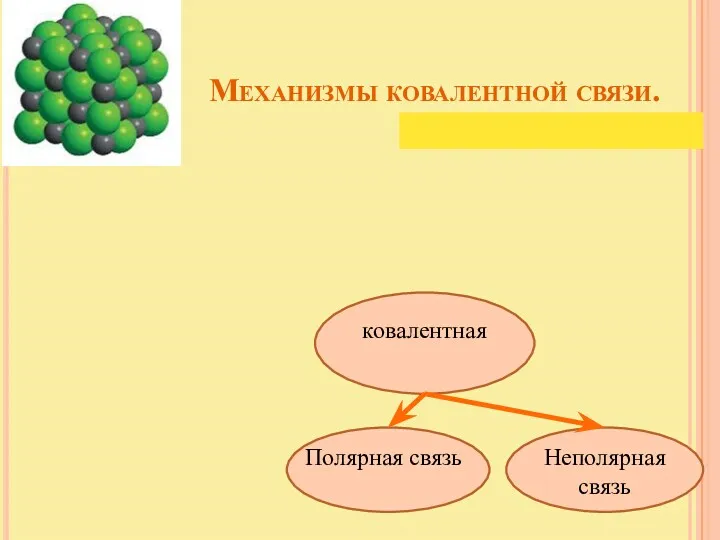
- 5. Механизмы ковалентной связи. ковалентная Полярная связь Неполярная связь
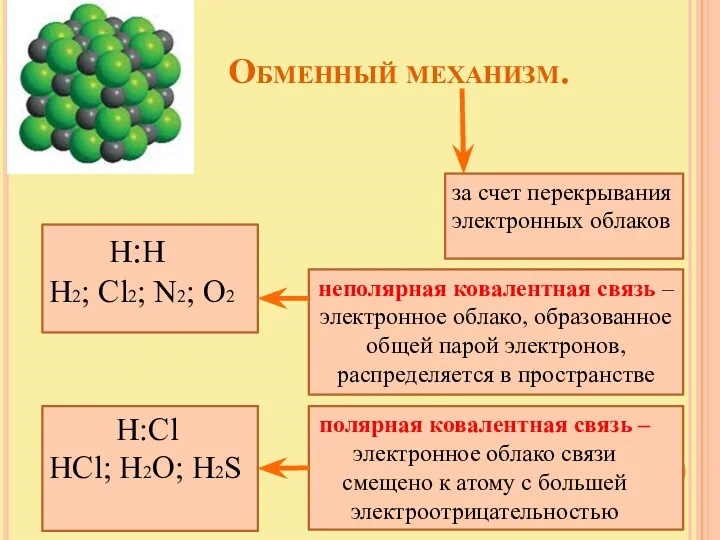
- 6. Обменный механизм. за счет перекрывания электронных облаков Н:Н Н2; Cl2; N2; O2 неполярная ковалентная связь –
- 7. Механизм образования ковалентной полярной связи Стр.195 записать в тетрадь образование HCL
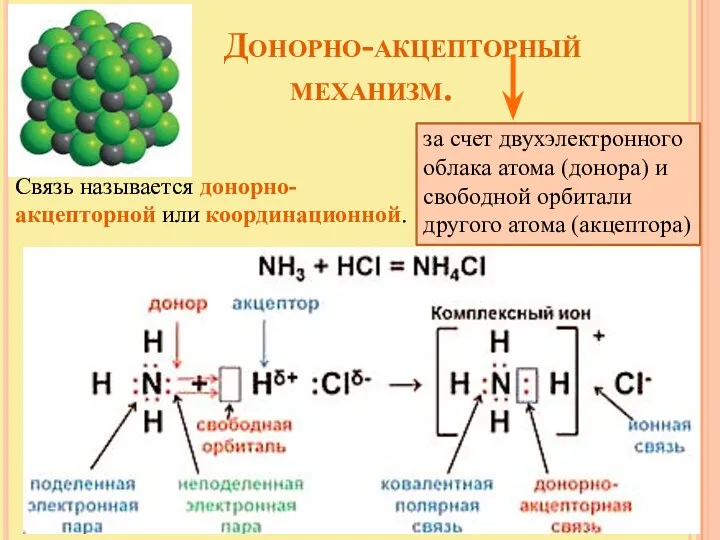
- 8. Донорно-акцепторный механизм. за счет двухэлектронного облака атома (донора) и свободной орбитали другого атома (акцептора) Связь называется
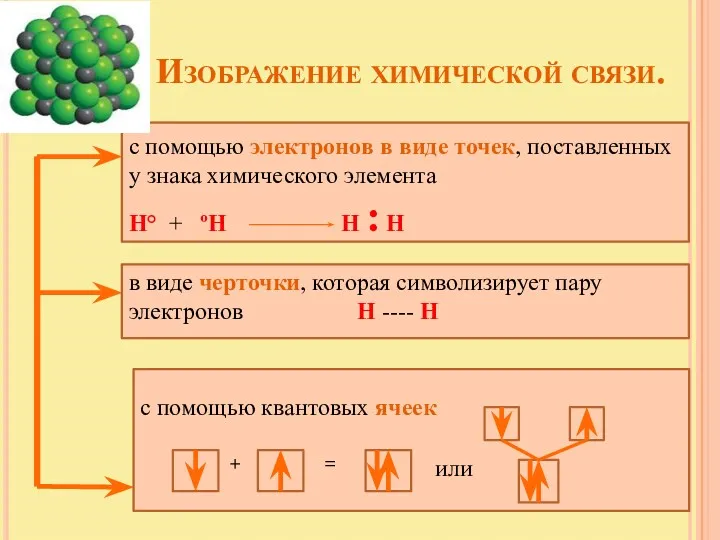
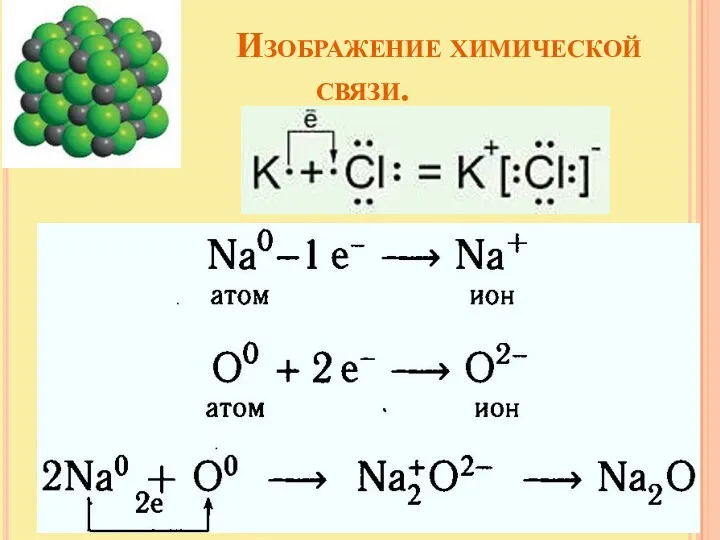
- 9. Изображение химической связи. с помощью электронов в виде точек, поставленных у знака химического элемента Н° +
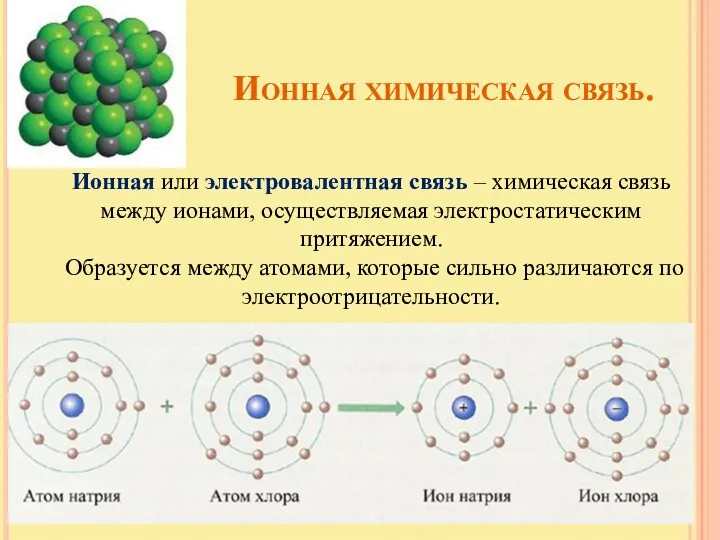
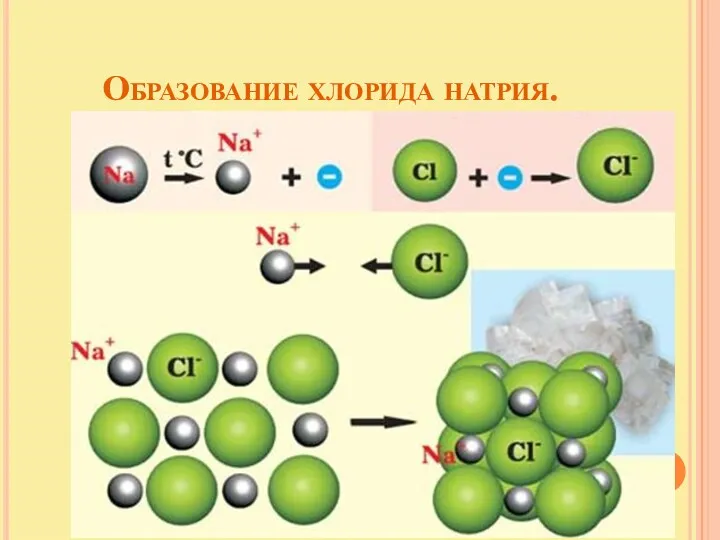
- 10. Ионная химическая связь. Ионная или электровалентная связь – химическая связь между ионами, осуществляемая электростатическим притяжением. Образуется
- 11. Образование хлорида натрия.
- 12. Изображение химической связи.
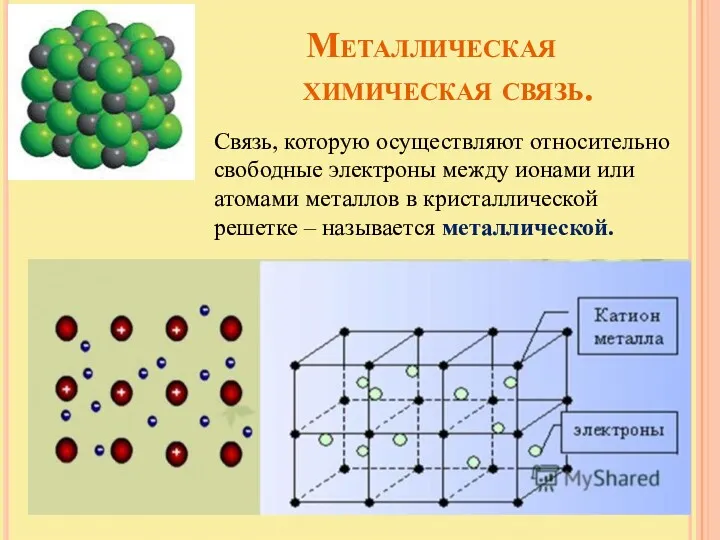
- 13. Металлическая химическая связь. Связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической
- 14. Особенности металлической связи. 1. Металлическую связь образуют элементы, атомы которых на внешнем уровне имеют мало валентных
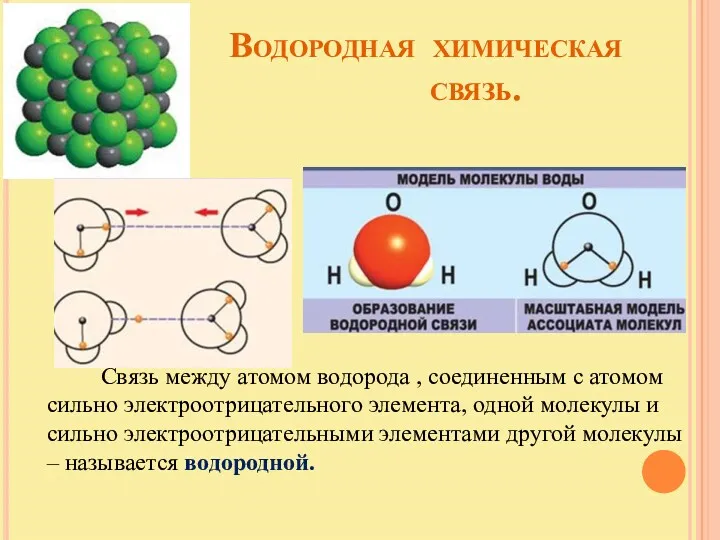
- 15. Водородная химическая связь. Связь между атомом водорода , соединенным с атомом сильно электроотрицательного элемента, одной молекулы
- 16. Особенности водородной химической связи. Связь относится к межмолекулярной; возможно образование внутримолекулярной водородной связи. Водородная связь вторая
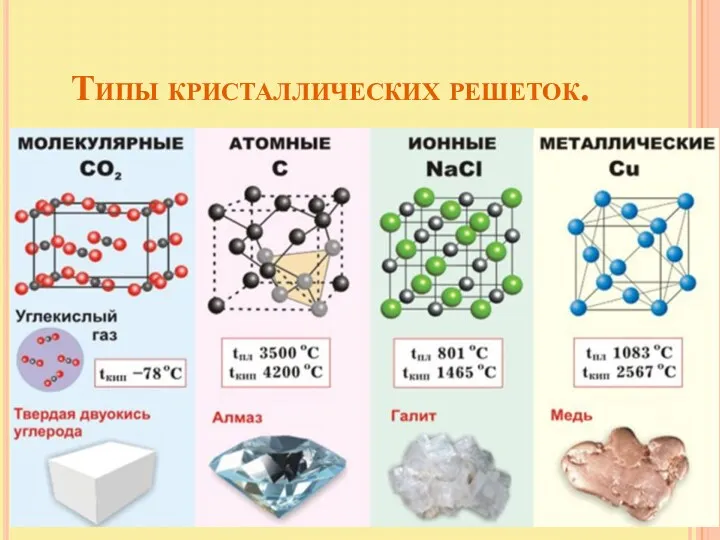
- 17. Типы кристаллических решеток.
- 19. Скачать презентацию



 Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування Катионы IV аналитической группы
Катионы IV аналитической группы Строение атома и периодический закон. (Тема 2)
Строение атома и периодический закон. (Тема 2) Қазақстанда химияны оқыту әдістемесінің даму тарихы
Қазақстанда химияны оқыту әдістемесінің даму тарихы Химическая промышленность
Химическая промышленность Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання Кислород/водород. Повторение
Кислород/водород. Повторение Лаборатория красивых волос
Лаборатория красивых волос Аммиак (9 класс)
Аммиак (9 класс) ферментер
ферментер Гидролиз солей
Гидролиз солей Химические свойства и получение алканов
Химические свойства и получение алканов Механическая смесь и растворы
Механическая смесь и растворы Химическая связь и ее типы. Кристаллические решётки
Химическая связь и ее типы. Кристаллические решётки Массовая доля элемента в веществе
Массовая доля элемента в веществе Цинк и его применение
Цинк и его применение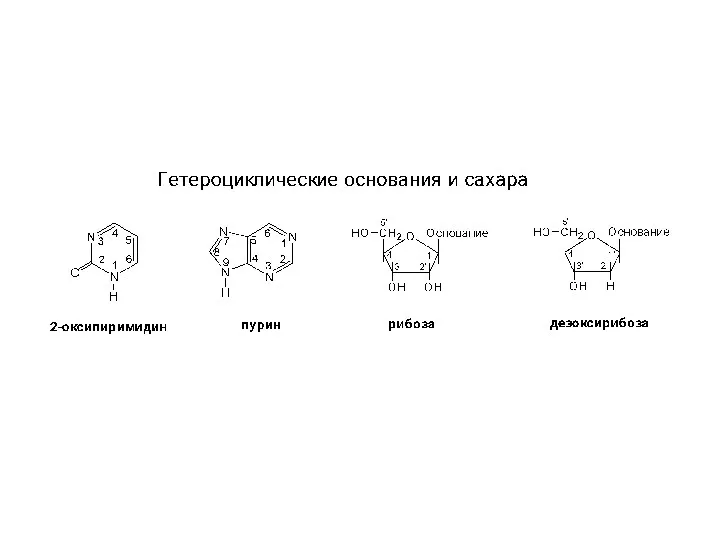 Структура гетероциклов, нуклеозидов и нуклеотидов
Структура гетероциклов, нуклеозидов и нуклеотидов Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Пластические массы и изделия на их основе
Пластические массы и изделия на их основе Химические уравнения
Химические уравнения p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Тотығу-тотықсыздану титрлеу әдісі
Тотығу-тотықсыздану титрлеу әдісі Химическая связь в кластерах
Химическая связь в кластерах Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Ionic polymerization
Ionic polymerization