Содержание
- 2. “ Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимется,
- 3. Современная формулировка закона сохранения массы веществ: Масса веществ,вступивших в химическую реакцию,равна массе веществ,получившихся в результате её.
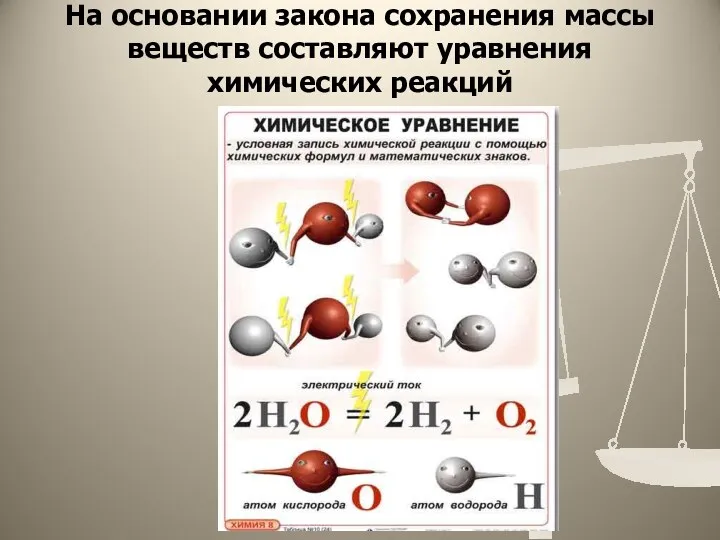
- 4. На основании закона сохранения массы веществ составляют уравнения химических реакций
- 5. Химическим уравнением - называют условную запись химической реакции с помощью химических формул и математических знаков (индексов
- 6. Правила составления химических уравнений 1. В левой части уравнения записать формулы реагентов. Затем поставить стрелку а)
- 7. 2. В правой части (после стрелки) записать формулы веществ, образующихся в результате реакции (продуктов) а) N2
- 8. 3. Уравнение реакции составляется на основе закона сохранения массы веществ, т. е. слева и справа должно
- 9. Алгоритм расстановки коэффициентов в уравнении химической реакции. 1. Подсчитать количество атомов каждого элемента в правой и
- 10. 2. Определить, у какого элемента количество атомов меняется, найти Н.О.К. N2 + H2 → NH3 2
- 11. 3. Разделить Н.О.К. на индексы – получить коэффициенты Поставить коэффициенты перед формулами 1N2 + 3H2 →
- 12. 4. Пересчитать количество атомов, при необходимости действия повторить N2 + 3H2 → 2NH3 2 6 6
- 13. 5. Начинать лучше с атомов О или любого другого неметалла (если только О не находится в
- 14. Расставьте коэффициенты: а) О2 + H2 → H2O б) Al(OH)3 → Al2O3 + H2O в) Mg
- 15. Проверь себя: а) N2 + 3H2 → 2NH3 б) 2Al(OH)3 → Al2O3 + 3H2O в) Mg
- 16. Новые вещества не получаются из ничего и не могут обратиться в ничто. При химических реакциях происходит
- 17. Расставьте коэффициенты и определите тип реакции: P + Cl2 → PCl5 Na2S → Na + S
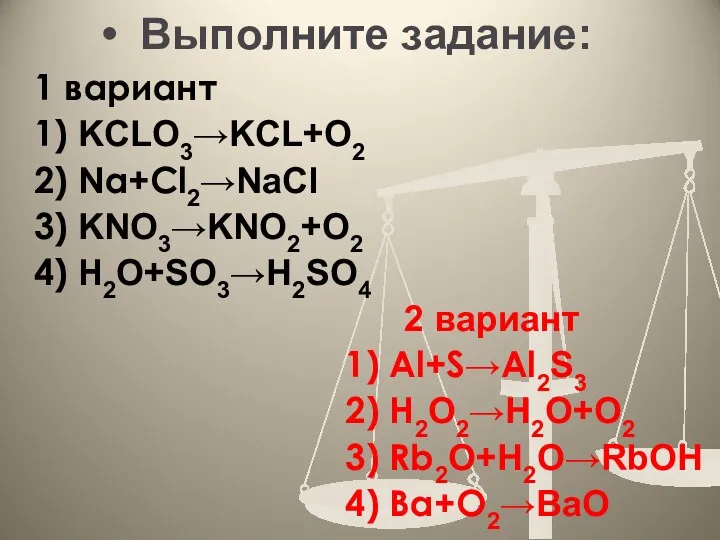
- 18. Выполните задание: 1 вариант 1) KCLO3→KCL+O2 2) Na+Cl2→NaCl 3) KNO3→KNО2+O2 4) H2O+SO3→H2SO4 2 вариант 1) Al+S→Al2S3
- 19. Расставьте коэффициенты:
- 21. Скачать презентацию












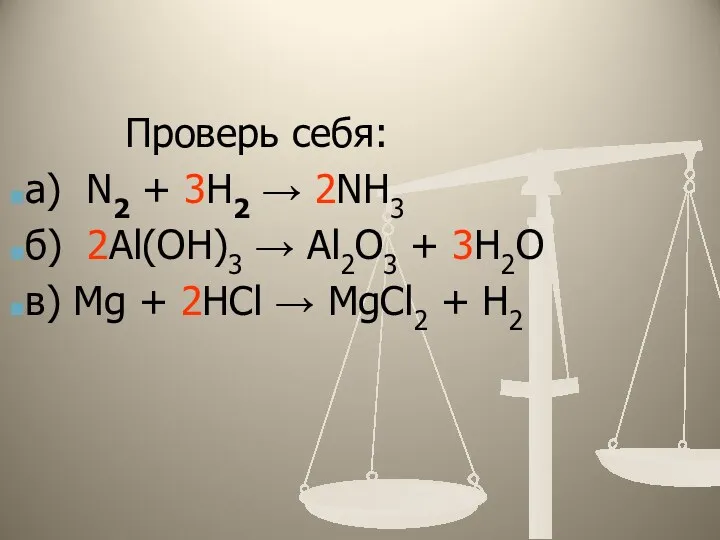



 р-элементы V группы (пниктогены) N, P, As, Sb, Bi
р-элементы V группы (пниктогены) N, P, As, Sb, Bi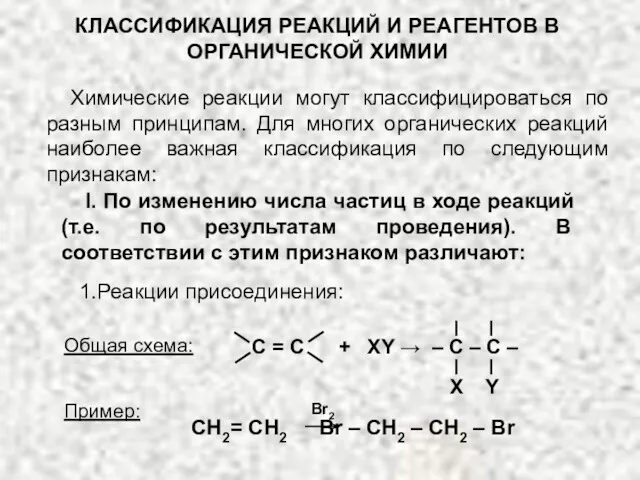 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Цинк. Нахождение в природе
Цинк. Нахождение в природе Урок-аукцион Фосфор и его свойства.
Урок-аукцион Фосфор и его свойства. 20231110_zakon_avogadro
20231110_zakon_avogadro Бытовая химия в нашем доме и альтернативные способы уборки
Бытовая химия в нашем доме и альтернативные способы уборки Растворы. (Лекция 7)
Растворы. (Лекция 7) Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень
Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень Презентации-задания к урокам химии по различным темам
Презентации-задания к урокам химии по различным темам Природные источники углеводородов
Природные источники углеводородов Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Оксид углерода-С
Оксид углерода-С Своя игра по химии
Своя игра по химии Небезпечні хімічні речовини
Небезпечні хімічні речовини Проблемный химический эксперимент как составная часть проблемного обучения химии
Проблемный химический эксперимент как составная часть проблемного обучения химии Строение и свойства металлов Физические и механические свойства металлов
Строение и свойства металлов Физические и механические свойства металлов Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Фосфор и его соединения
Фосфор и его соединения Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар
Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар Роль химии в создании новых материалов
Роль химии в создании новых материалов Циклоалканы. Строение циклоалканов
Циклоалканы. Строение циклоалканов Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Введение в химическую технологию топлив и углеродных материалов
Введение в химическую технологию топлив и углеродных материалов Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16)
Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16) Распределение лучистой энергии в спектре солнечной радиации до поступления в атмосферу и в спектре абсолютно черного тела
Распределение лучистой энергии в спектре солнечной радиации до поступления в атмосферу и в спектре абсолютно черного тела Номенклатура органических веществ
Номенклатура органических веществ Изотопный обмен
Изотопный обмен