Содержание
- 2. 2
- 3. Общая характеристика N P As 2s22p3 3s23p3 4s24p3 Sb 5s25p3 Bi 6s26p3 типические rа Еион. Метал.
- 4. Общая характеристика N - неметалл P – неметалл, Pчерный – п/п As, Sbжелтый- немет. Sbсерый -
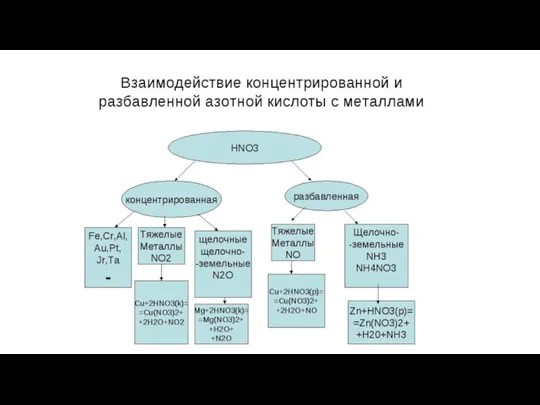
- 5. Общая характеристика P + HNO3(конц.) → H3PO4 + NO2 + H2O As + HNO3(конц.) → HAsO3
- 6. Степени окисления Характерные Устойчивые N P -3 ÷ +5 -3 +1 +3 +5 +5 +5 +3,+5
- 7. Природные cоединения Кларк As 5·10-4 As2S3 Sb 5·10-5 Sb2S3 Bi 2·10-5 Bi2S3 N P 0,04 0,09
- 8. Азот, его свойства и значение
- 11. Открытие азота 12 сентября 1772 года — Даниель Резерфорд 1771 - 1773 гг. — Г. Кавендиш
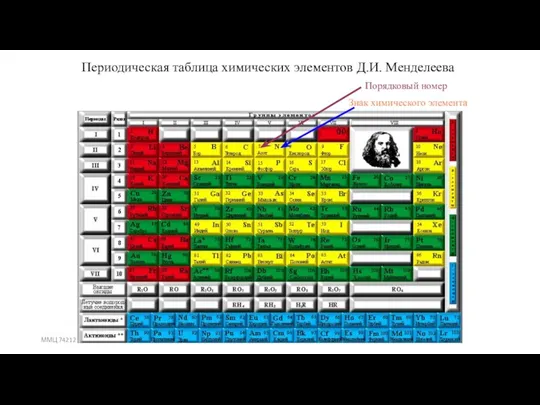
- 12. ММЦ 74212 Периодическая таблица химических элементов Д.И. Менделеева Порядковый номер Знак химического элемента
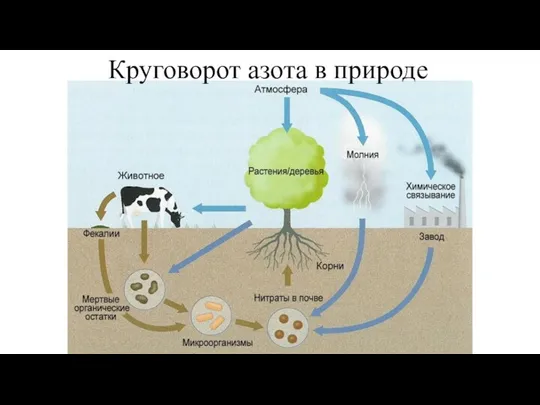
- 13. Круговорот азота в природе
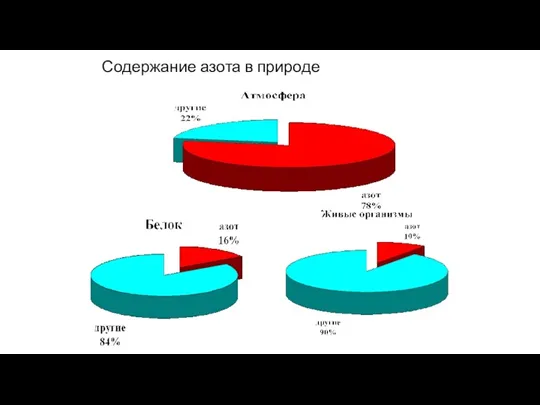
- 14. Содержание азота в природе
- 15. Строение атома азота +7 2е 5е N 1s2 2s2 2p3 Валентность = III
- 16. Азот - простое вещество N2 N N N N Молекулярная формула Электронная формула Структурная формула ковалентная
- 17. Азот [аzоо] - безжизненный N …2s22p3 Ст.окисления: -3 -2 -1 -1/3 NH3 N2H4 NH2OH HN3 NH4+
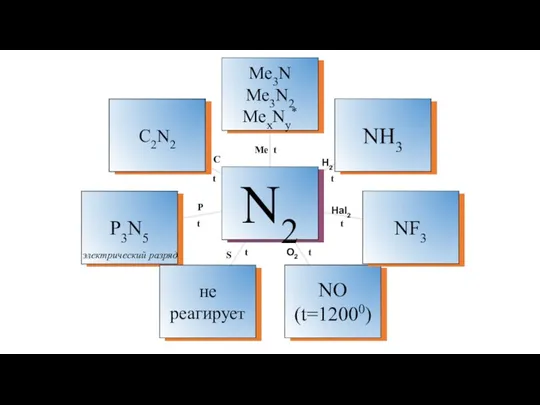
- 18. Ме Н2 Hal2 O2 S P C t t t t t t t электрический разряд
- 19. Химические свойства атома азота Окислительные свойства N0+3e N-3 Ca3N2 AlN H3N (аммиак) нитриды Восстановительные свойства N
- 21. Химические свойства вещества азота Окислительные свойства Восстановительные свойства Взаимодействие с металлами (to, с литием при комнатной
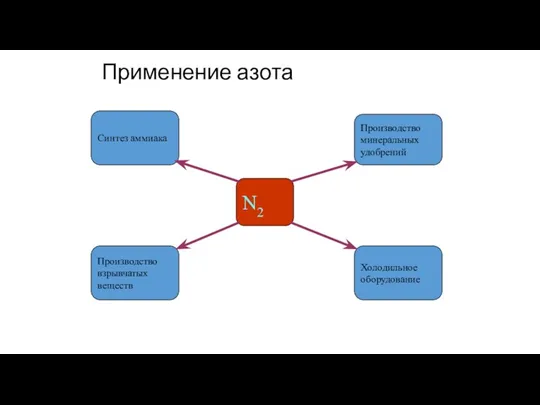
- 22. Применение азота N2 Синтез аммиака Холодильное оборудование Производство взрывчатых веществ Производство минеральных удобрений
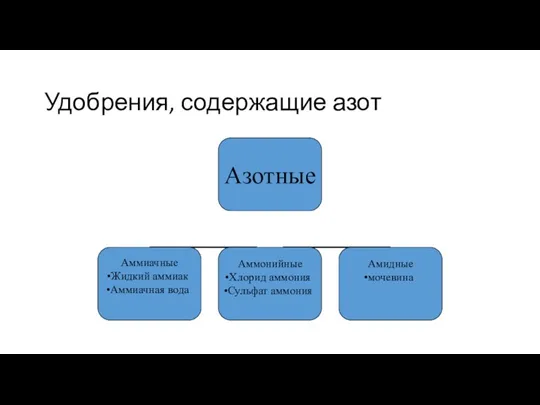
- 23. Удобрения, содержащие азот
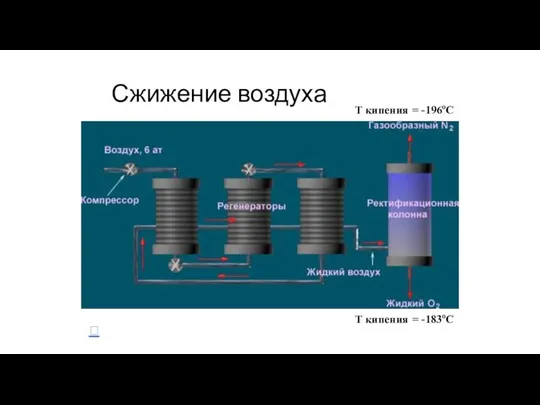
- 24. Получение азота Сжижение воздуха ? Взаимодействие нитрита натрия с хлоридом аммония ?
- 25. Сжижение воздуха T кипения = -196oC T кипения = -183oC ⮱
- 26. Реакция получения N2 NaNO2 нитрит натрия + NH3Cl хлорид аммония = NaCl + N2? 2H2O +
- 28. Азотная кислота
- 31. Получение аммиака N2 + 3H2 ↔ 2NH3 t = 850оС Р = 5000 атм t =
- 32. Получение аммиака
- 33. Физические cв-ва NH3 Газ, с резким запахом, токсичен. tк = - 33оС
- 34. Химические cв-ва аммиака NH3 - восстановитель, т.к. N-3 но: NH3 (ж) + Nа → NаNH2 +
- 35. Химические cв-ва аммиака NH3 - основание Льюиса NH3 + HCl NH4Cl NH3 + H2SO4 (разб.)
- 36. Соединения азота в (-) ст. ок. Ст. ок. -3 -2 -1 Аммиак и его производные NH3
- 37. 2Na + 2NH3(ж) = 2NaNH2 + H2↑ NaNH2 + H2O = NaOH + NH3↑ М +
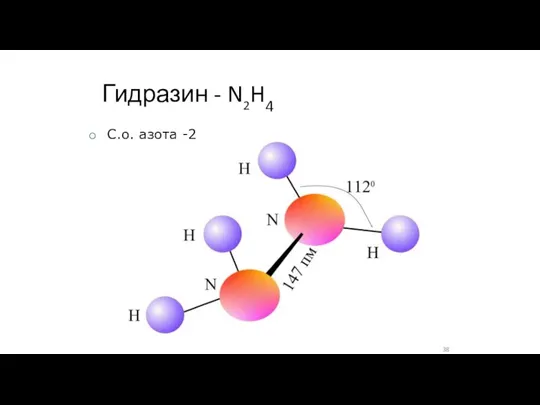
- 38. Гидразин - N2H4 C.о. азота -2
- 39. N2H4 – жидкость 2 5 N2H4 +H2O N2H5OH OH- + N H + гидроксид гидрозония N2H5Cl
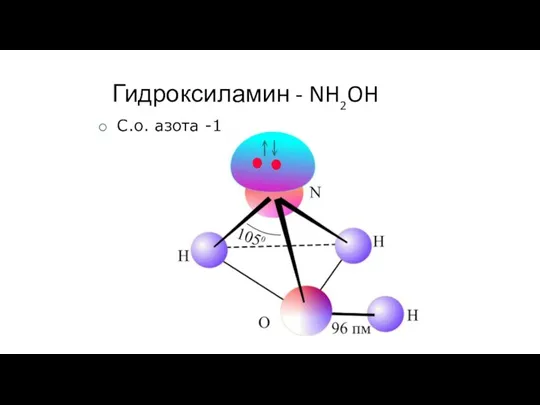
- 40. Гидроксиламин - NH2OH С.о. азота -1
- 41. NH2OH+H2O NH3(OH)2 NH3(OH)2 OH-+ NH3OH+ гидроксид гидроксиламмония Соли: (NH3OH)Cl хлорид гидроксиламмония (NH3OH)2SO4 сульфат гидроксиламмония
- 43. Скачать презентацию











![Азот [аzоо] - безжизненный N …2s22p3 Ст.окисления: -3 -2 -1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/321498/slide-16.jpg)

















 Полимерные материалы. Пластические массы и строительные материалы на их основе
Полимерные материалы. Пластические массы и строительные материалы на их основе Фракционирование клеточных экстрактов
Фракционирование клеточных экстрактов Теоретические основы металлургии. Благородные металлы
Теоретические основы металлургии. Благородные металлы Галогены (солеобразующие)
Галогены (солеобразующие) Разноцветные кристаллы
Разноцветные кристаллы Химические свойства неорганических соединений. Лабораторная работа
Химические свойства неорганических соединений. Лабораторная работа 20230419_izomery
20230419_izomery Омыватель лобового стекла
Омыватель лобового стекла Состав энергетических напитков
Состав энергетических напитков Алканы. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза
Алканы. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза Спирты одноатомные и многоатомные
Спирты одноатомные и многоатомные Алюминий
Алюминий Карбоновые кислоты
Карбоновые кислоты Термическая переработка газов, нефтяных фракций и остатков нефтепереработки
Термическая переработка газов, нефтяных фракций и остатков нефтепереработки Водород. Растворы. 8 класс
Водород. Растворы. 8 класс Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Тотығу-тотықсыздану реакциялары. Тотығу және тотықсыздану
Тотығу-тотықсыздану реакциялары. Тотығу және тотықсыздану Виды вспомогательного оборудования химических производств
Виды вспомогательного оборудования химических производств Превращение веществ
Превращение веществ Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов
Подготовка к ГИА. А9. Химические свойства простых веществ: металлов и неметаллов Складання рівнянь окисно-відновних реакцій. Метод електронного балансу
Складання рівнянь окисно-відновних реакцій. Метод електронного балансу Закон сохранения массы вещества. Химические уравнения
Закон сохранения массы вещества. Химические уравнения Магматические горные породы
Магматические горные породы Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Алкены (олефины). 10 профиль. Лекция №1
Алкены (олефины). 10 профиль. Лекция №1 Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Амины. Анилин
Амины. Анилин Галогены. Историческая справка
Галогены. Историческая справка