Алканы. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза презентация
Содержание
- 2. Лекция № 2 Тема: «АЛКАНЫ» План: 1. Общая характеристика, гомологический ряд, номенклатура, изомерия. 2. Методы синтеза
- 3. 1. Общая характеристика, гомологический ряд, номенклатура, изомерия. Алканы – алифатические углеводороды, в молекулах которых атомы углерода
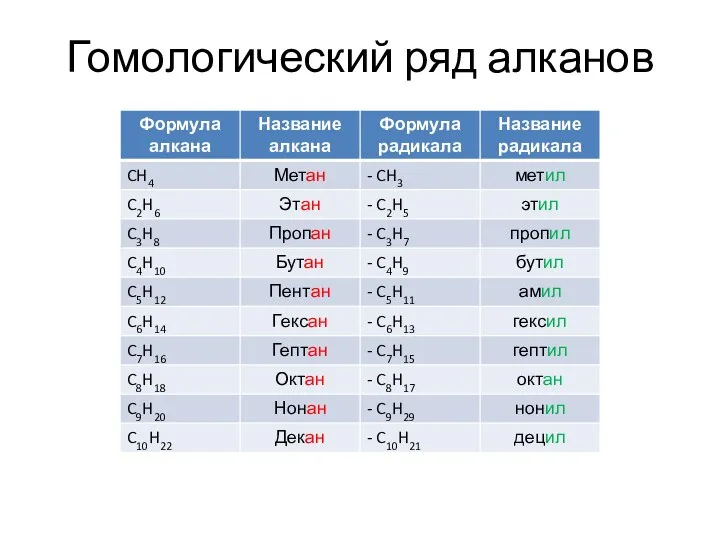
- 4. Гомологический ряд алканов
- 5. Изомерия Атомы углерода в молекулах алканов находятся в SP3 – гибризизации. Для алканов характерна структурная изомерия-
- 6. Систематическая (международная) номенклатура 1. Выбираем самую длинную цепочку. 2. Нумеруем её с той стороны, где ближе
- 7. Рациональная номенклатура 1. Выбираем центральный атом и обозначаем его *. Центральный атом тот, который имеет максимальное
- 8. 2. Методы синтеза алканов. Для получения алканов используют в основном природные источники. Газообразные алканы получают из
- 9. 3. Щелочной гидролиз солей карбоновых кислот ( лабораторный способ получения – берём смесь Na2CO3 + Са(ОН)2,
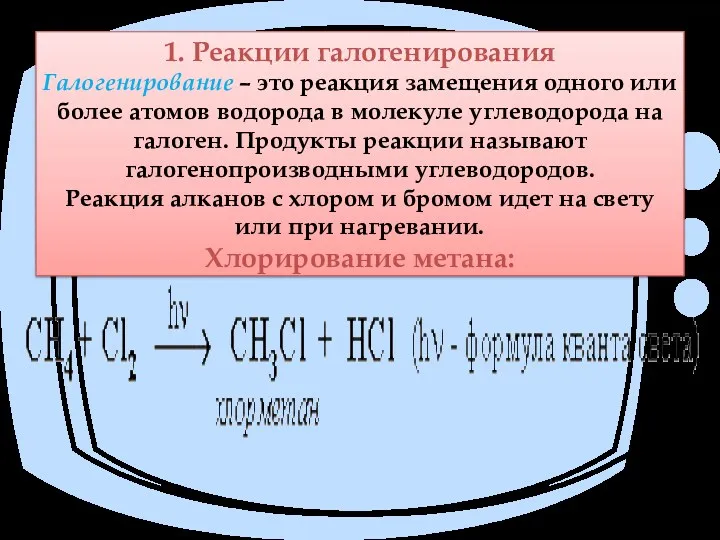
- 10. 1. Реакции галогенирования Галогенирование – это реакция замещения одного или более атомов водорода в молекуле углеводорода
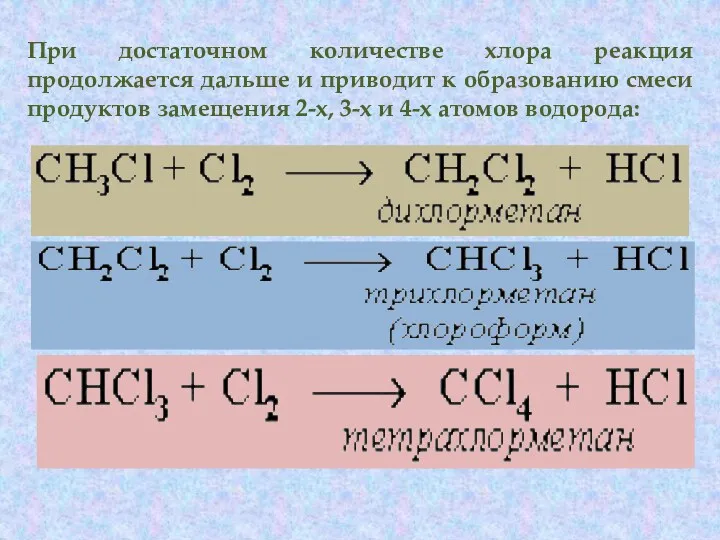
- 11. При достаточном количестве хлора реакция продолжается дальше и приводит к образованию смеси продуктов замещения 2-х, 3-х
- 12. При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода
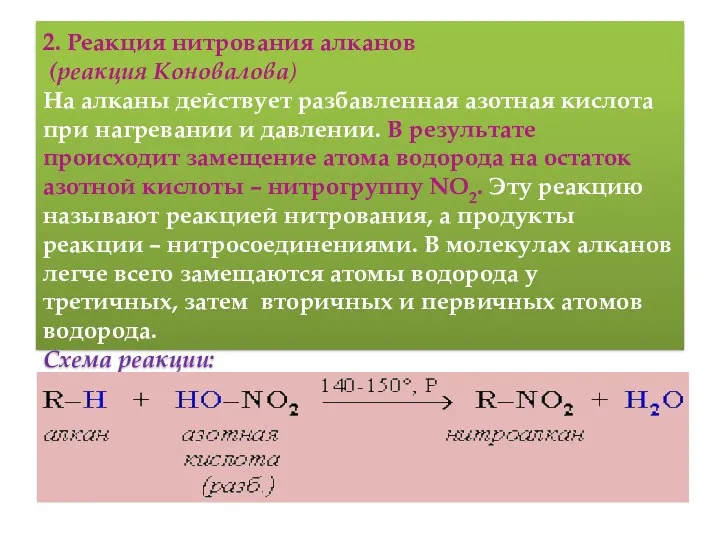
- 13. 2. Реакция нитрования алканов (реакция Коновалова) На алканы действует pазбавленная азотная кислота пpи нагpевании и давлении.
- 14. 3. Реакции горения алканов Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается
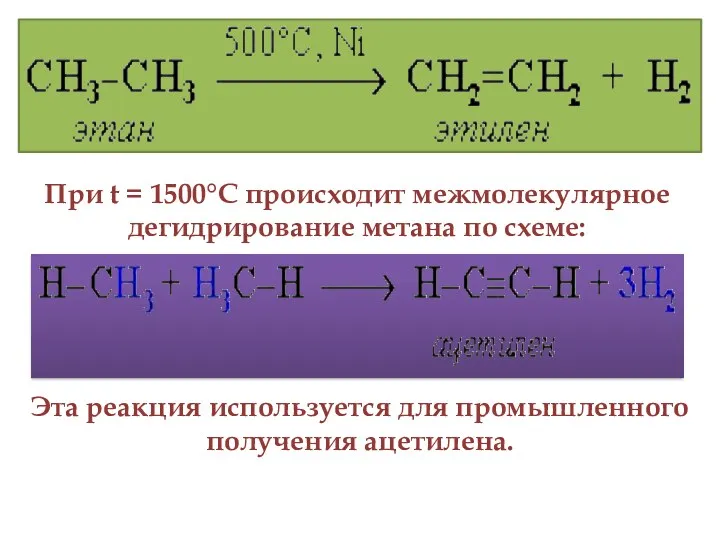
- 15. 4. Реакция дегидрирования алканов По связям С–Н возможны реакции отщепления атома водорода (дегидрирование). При нагревании алканов
- 16. При t = 1500°С происходит межмолекулярное дегидрирование метана по схеме: Эта реакция используется для промышленного получения
- 17. 4. Отдельные представители. Метан - СН4 – бесцветный газ, без запаха, мало растворим в воде, легче
- 19. Скачать презентацию











 Сhemistry in English and chemical elements in English
Сhemistry in English and chemical elements in English Химическая термодинамика
Химическая термодинамика Кремний и его соединения
Кремний и его соединения Ізомерія. Структурна ізомерія
Ізомерія. Структурна ізомерія Первичная переработка нефти
Первичная переработка нефти Аммиак. Физические и химические свойства. Получение, применение
Аммиак. Физические и химические свойства. Получение, применение Этимология химических элементов
Этимология химических элементов Фуллерендер құрылымдары және олардың түрлерi
Фуллерендер құрылымдары және олардың түрлерi Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин
Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин Періодична система хімічних елементів
Періодична система хімічних елементів Хроматографические методы анализа
Хроматографические методы анализа Полудрагоценные камни
Полудрагоценные камни Жёсткость воды и способы её устранения. Практическая работа №6. 9 класс
Жёсткость воды и способы её устранения. Практическая работа №6. 9 класс Алкены (олефины). Лекция 3
Алкены (олефины). Лекция 3 Знаки химических элементов. Периодическая система химических элементов
Знаки химических элементов. Периодическая система химических элементов Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Соли, как производные кислот и оснований. Их состав и номенклатура
Соли, как производные кислот и оснований. Их состав и номенклатура Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2) Высокомолекулярные соединения (ВМС) или полимеры
Высокомолекулярные соединения (ВМС) или полимеры NaOH. Гидроксид натрия
NaOH. Гидроксид натрия Основы химической термодинамики
Основы химической термодинамики Арены. Бензол и его гомологи. Химия. 10 класс
Арены. Бензол и его гомологи. Химия. 10 класс Оксид серы(4). Сернистая кислота и её соли
Оксид серы(4). Сернистая кислота и её соли Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Фенолы-1
Фенолы-1 Загрязнение почв пестицидами. Проблемы и решения
Загрязнение почв пестицидами. Проблемы и решения Химические реакции или химические явления
Химические реакции или химические явления Строение и свойства циклоалканов.
Строение и свойства циклоалканов.