Содержание
- 2. Спроби класифікацій хімічних елементів В хімії існують класифікації елементів, речовин, хімічних реакцій Класифікація - це розподіл
- 3. В кінці ХVІІІ ст. А.-Л. Лавуазьє запропонував першу класифікацію хімічних елементів. Він розділив прості речовини на
- 4. Вчені об'єднали їх в окремі групи. Прості речовини кожної групи отримали такі загальні назви: Лужні метали
- 5. У ХІХ ст. німецький вчений В. Деберейнер розподілив частину подібних елементів на тріади. 1 тріада -
- 6. Він помітив, що в багатьох випадках кожний восьмий елемент є подібним до обраного за перший (таку
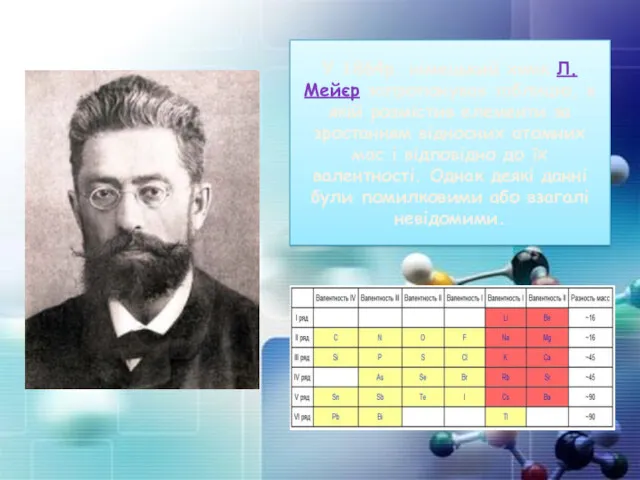
- 7. У 1864р. німецький хімік Л.Мейєр запропонував таблицю, в якій розмістив елементи за зростанням відносних атомних мас
- 8. Періодична система Д.І. Менделеева. Історія відкриття періодичного закону. «Познавая бесконечное, наука сама бесконечна» Д.І.Менделєєв
- 9. Періодичний закон відкритий Д. І. Менделєєвим в березні 1869 року при зіставленні властивостей всіх відомих на
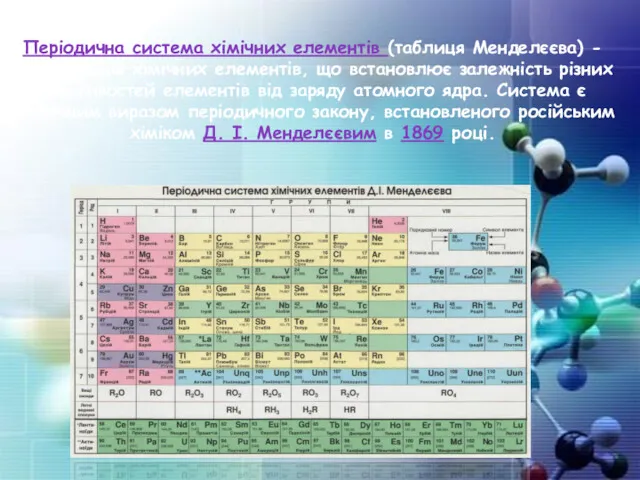
- 10. Періодична система хімічних елементів (таблиця Менделєєва) - класифікація хімічних елементів, що встановлює залежність різних властивостей елементів
- 11. Періоди — це горизонтальні ряди в таблиці Менделєєва. Періоди поділяються на малі, що складаються з одного
- 12. Зіставляючи між собою відомі на той час хімічні елементи, Менделєєв після колосальної роботи відкрив, нарешті, ту
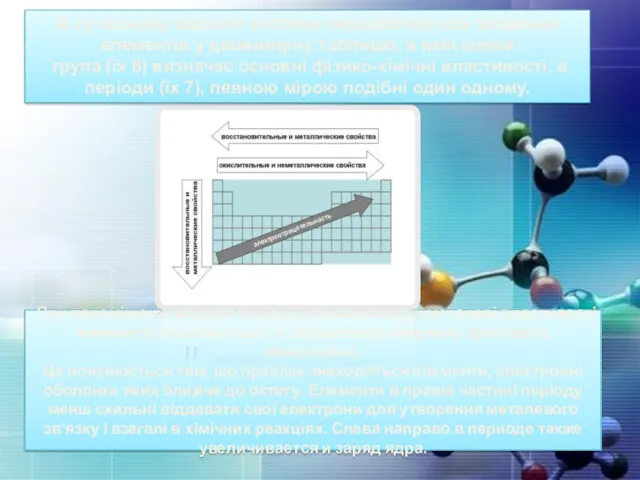
- 13. При переміщенні вздовж періоду справа ліворуч металеві властивості елементів посилюється. У зворотному напрямку зростають неметалічні. Це
- 14. Був направлений учителем гімназії спочатку в Сімферополь, а потім в Одесу. У 1856 р. Дмитро Менделєєв
- 16. Скачать презентацию








 Фосфор и его соединения
Фосфор и его соединения Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Дистилляция и ректификация
Дистилляция и ректификация Металлы и их соединения
Металлы и их соединения Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры
Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры Углеводы
Углеводы Металлическая связь
Металлическая связь Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Стирка по научному
Стирка по научному Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Спирты. Классификация, номенклатура, изомерия спиртов
Спирты. Классификация, номенклатура, изомерия спиртов Строение атома
Строение атома Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Атом – сложная частица
Атом – сложная частица Элементы пятой-А группы. Азот и фосфор
Элементы пятой-А группы. Азот и фосфор Идеальные и реальные кристаллы
Идеальные и реальные кристаллы Электрохимические процессы
Электрохимические процессы Ядерное топливо
Ядерное топливо Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Качественные реакции
Качественные реакции 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft Аминокислоты, как структурные компоненты белков
Аминокислоты, как структурные компоненты белков Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Внеклассное мероприятие по химии. 9 класс
Внеклассное мероприятие по химии. 9 класс Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)
Водород. Характеристика положения водорода в ПСХЭ, строение атома и молекулы (8 класс)