Содержание
- 2. Термодинамика –это наука о превращениях различных видов энергии друг в друга. Все химические реакции сопровождаются энергетическими
- 3. Первый закон термодинамики. Основные понятия Теплота Q, подводимая к термодинамической системе, расходуется на изменение внутренней энергии
- 4. Внутренняя энергия U – это энергия частиц, составляющих данную систему. Внутренняя энергия идеального газа зависит только
- 5. В зависимости от условий протекания различают 4 типа процессов: изохорный – протекает при постоянном объеме (V=const);
- 6. Химические процессы протекают либо при постоянном объеме (V=const), либо при постоянном давлении (p=const). а) V=const dV=0,
- 7. QP =∆U + А = ( U2 –U1 ) + p ∙ ( V2 – V1
- 8. Тепловой эффект реакции – количество выделенной или поглощенной в ходе реакции теплоты. По знаку теплового эффекта
- 9. Термохимические уравнения – это химические уравнения, в которых указывается тепловой эффект реакции ∆ H и состояние
- 10. 2 С + О2 = 2 СО; ∆Н0298 = - 221 кДж. (графит) (г) (г) В
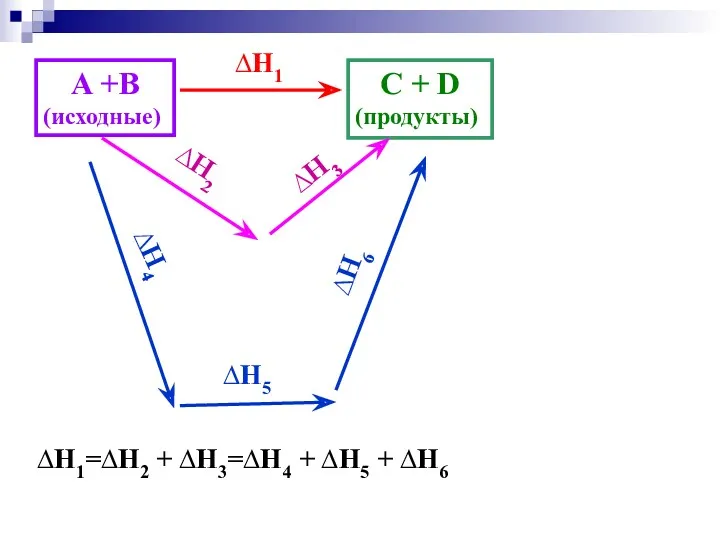
- 11. 2. Закон Гесса Тепловой эффект процесса зависит только от вида и состояния исходных веществ и продуктов
- 12. A +B (исходные) C + D (продукты) ∆Н1 ∆Н2 ∆Н3 ∆Н4 ∆Н5 ∆Н6 ∆Н1=∆Н2 + ∆Н3=∆Н4
- 13. Следствие из закона Гесса Тепловой эффект реакции равен сумме теплот образования продуктов реакции минус сумма теплот
- 14. ∆Н0=∑ ∆Н0(прод) - ∑ ∆Н0(исх) Суммирование ведется по каждому молю, т.е. с учетом коэффициентов: если в
- 15. Второй закон термодинамики Самопроизвольно в изолированной системе могут протекать только те процессы, которые сопровождаются повышением энтропии.
- 16. Она растет при: - повышении температуры, - плавлении, - кипении, - сублимации (возгонке), - расширении и
- 17. [S0]=Дж/моль·К, это справочная величина. ∆S0=∑ S0(прод) - ∑ S0(исх) Суммирование ведется по каждому молю, т.е. с
- 18. Критерий направленности процесса Существует потенциал, характеризующий химические процессы, протекающие при p, T=const, он называется изобарно-изотермический потенциал,
- 19. ∆G ∆G=0 ∆G>0 Возможность самопроизвольного протекания реакции в прямом направлении. ∆Gпрямой= - ∆Gобратной Невозможность самопроизвольного протекания
- 20. Существует 2 способа расчета Δ G. Аналогично расчету Δ H и Δ S aA + bB
- 21. 2) Расчет по уравнению Гиббса ∆G0 = ∆Н0 - T ∆S0 Реакция, не идущая самопроизвольно при
- 22. Задача CH4 + CO2 = 2 CO + 2 H2 (г) (г) (г) (г) Определить тепловой
- 23. 2) Определить изменение энтропии ∆S0 ∆S0=∑ S0(прод) - ∑ S0(исх)= =(2 ·S0(СO) +2 · S0(Н2)) -
- 24. 3) Определить изменение энергии Гиббса ∆G0 ∆G0 = ∆Н0 - T ∆S0 = =247,32 кДж –
- 25. 4) При какой температуре процесс пойдет самопроизвольно Любой процесс идет самопроизвольно при температуре равновесия. В этом
- 27. Скачать презентацию














![[S0]=Дж/моль·К, это справочная величина. ∆S0=∑ S0(прод) - ∑ S0(исх) Суммирование](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/611891/slide-16.jpg)








 Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6
Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6 Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Крахмал. Физические свойства
Крахмал. Физические свойства Типы химических реакций
Типы химических реакций Сплавы и их свойства. Легирующие добавки
Сплавы и их свойства. Легирующие добавки Organic Compounds
Organic Compounds Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Загальні способи добування солей. Класифікація неорганічних речовин
Загальні способи добування солей. Класифікація неорганічних речовин Теория электролитической диссоциации
Теория электролитической диссоциации Титриметрический метод анализа
Титриметрический метод анализа Магний (Mg)
Магний (Mg) Катализ кислотами и основаниями. Лекция 3
Катализ кислотами и основаниями. Лекция 3 Теория электролитической диссоциации
Теория электролитической диссоциации Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Електроліз. Найпоширеніші способи застосування
Електроліз. Найпоширеніші способи застосування Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов
Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов Лекция 6. Алициклические углеводороды (циклоалканы, нафтены)
Лекция 6. Алициклические углеводороды (циклоалканы, нафтены) Периодический закон Д.И. Менделеева. Строение атома. Химическая связь
Периодический закон Д.И. Менделеева. Строение атома. Химическая связь Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Ионы и ионная химическая связь
Ионы и ионная химическая связь Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Неметаллы VIА-подгруппы
Неметаллы VIА-подгруппы Обратимые реакции. Химическое равновесие. Смещение равновесия
Обратимые реакции. Химическое равновесие. Смещение равновесия Игрушка слайм-лизун. Создание собственной игрушки-лизуна в домашних условиях
Игрушка слайм-лизун. Создание собственной игрушки-лизуна в домашних условиях Алкены. Химия
Алкены. Химия