Слайд 2

Вещества можно классифицировать
По составу
По агрегатному состоянию
По происхождению
Слайд 3

Слайд 4

«Подарки» природы
Сера
Уголь
Кремний
Серебро
Золото
Платина
Слайд 5

«Подарки» природы
Природный газ
Нефть
Слайд 6

«Подарки» природы
Вода
Кремнезем (кварц, опал, аметист)
Глинозем,боксит, корунд
Красный и бурый железняки
Слайд 7

«Подарки» природы
Каменная соль (галенит)
Сода (натрит)
Известняк (мел, мрамор)
Апатиты, фосфориты
Слайд 8

Используя эти «подарки», получите следующие вещества:
Водород
Алюминий
Железо
Гашеную известь
Угольную кислоту
Фосфорную кислоту
Фосфат натрия
Слайд 9
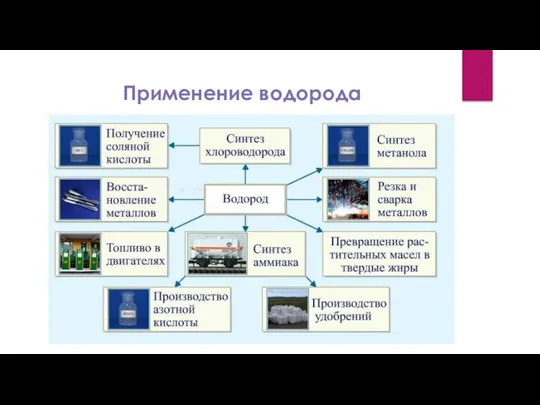
Слайд 10

Слайд 11

Слайд 12

Слайд 13

Средний американец выпивает 180 л газированной воды в год; средний россиянин — 50
л, средний китаец — 20 л воды в год
Слайд 14
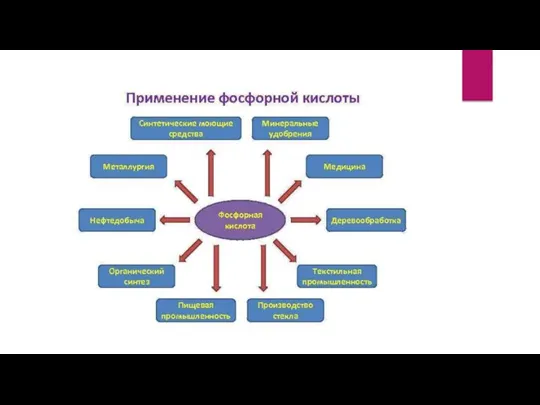
Слайд 15

Слайд 16

Реакции разложения
2H2O → 2H2 + O2
CH4 → С + 2H2
2Al2О3
→ 4Al + 3О2
Ca3(PO4)2 → P2O5 + 3CaO
CaCO3 → CaO + CO2
Слайд 17
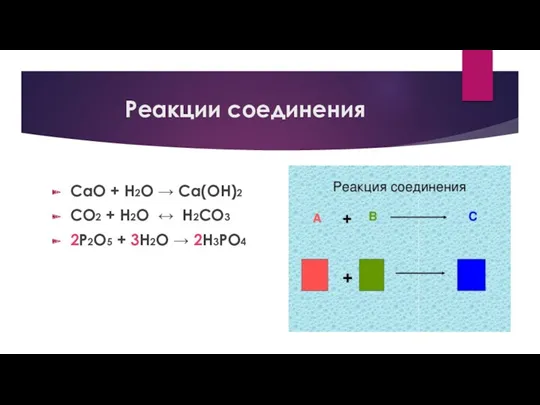
Реакции соединения
CaO + H2O → Ca(OH)2
СО2 + Н2О ↔ Н2СО3
2P2O5 +
3Н2О → 2H3PO4
Слайд 18

Реакции замещения
Al2O3 + 3H2 → 3H2O + 2Al
Fe2O3 + 2Al → Al2O3 +
2Fe
Fe2O3 + 3C → 3CO + 2Fe
Слайд 19

Реакция обмена
3Na2CO3 + 2H3PO4 → 2Na3PO4 + 3H2O + 3CO2


















 20230814_obobshchenie_po_teme_nemetally
20230814_obobshchenie_po_teme_nemetally Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9
Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9 Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Элемент № 24 периодической таблицы. Хром
Элемент № 24 периодической таблицы. Хром Белки – высокомолекулярные природные соединения (биополимеры)
Белки – высокомолекулярные природные соединения (биополимеры) Материаловедение. Строение вещества. Металлы и сплавы
Материаловедение. Строение вещества. Металлы и сплавы Химическая промышленность
Химическая промышленность Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Амины. Анилин
Амины. Анилин Чистые вещества и смеси
Чистые вещества и смеси Углеводы. Моносахариды. Дисахариды. Полисахариды
Углеводы. Моносахариды. Дисахариды. Полисахариды Облагораживание тяжелых нефтей и природных битумов
Облагораживание тяжелых нефтей и природных битумов Предмет химии. Вещества
Предмет химии. Вещества Задачи
Задачи Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Менделеевские уроки. День науки
Менделеевские уроки. День науки Химический элемент алюминий
Химический элемент алюминий Иодометрия. Комплексиметрия (начало)
Иодометрия. Комплексиметрия (начало) Высокомолекулярные вещества и их растворы
Высокомолекулярные вещества и их растворы Азот. Физические и химические свойства. Распространенность азота в природе. Способы получения
Азот. Физические и химические свойства. Распространенность азота в природе. Способы получения Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Вещества и их превращения Роль химии в нашей жизни
Вещества и их превращения Роль химии в нашей жизни Общая характеристика неметаллов
Общая характеристика неметаллов Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи
Физико-химические свойства органических веществ. Номенклатура, изомерия, задачи Химические основы жизни
Химические основы жизни Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы