Содержание
- 2. Положение в Периодической системе. Al Номер элемента Период Группа Подгруппа
- 3. Нахождение в природе. Al Боксит Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3) Нефелины KNa3[AlSiO4]4
- 4. Нахождение в природе. Al Глинозем Полевой шпат
- 5. Нахождение в природе. Al Корунд Берилл
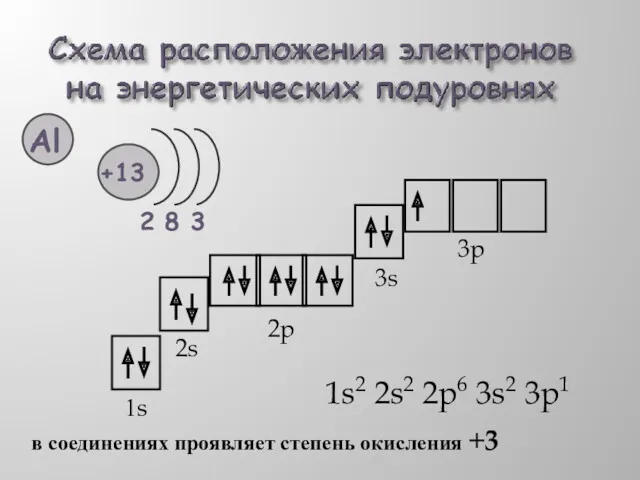
- 6. 1s2 2s2 2p6 3s2 3p1 1s 2s 2p 3s 3p в соединениях проявляет степень окисления +3
- 7. Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает хорошей ковкостью, легко
- 8. Химические свойства. I) Взаимодействие с простыми веществами:
- 9. Химические свойства II) Взаимодействие со сложными веществами. Взаимодействие с водой: Al + H2O = Al(OH)3 +
- 10. Химические свойства II) Взаимодействие со сложными веществами. 3) Взаимодействие с кислотами: Al + H2SO4 = Al2(SO4)3
- 11. Соединения алюминия: Al2O3 – оксид алюминия Корунд - оксид алюминия - наиболее твердое вещество на Земле
- 12. Корунд Мелко кристаллические непрозрачные разновидности серовато-черного цвета называют наждаком и применяется в качестве абразивного материала.
- 13. Корунд Корунд удивительно многолик. В коллекции минералогического музея Санкт-Петербургского горного института хранятся корунды более 40 оттенков:
- 14. Корунд
- 15. Корунд
- 16. Корунд
- 17. Корунд Наиболее драгоценными корундами являются рубины и сапфиры. Их окраска, как и во всех прочих случаях,
- 18. Корунд Ti4+ , Fe2+ , Fe3+ придают синий цвет (сапфир)
- 19. Корунд Эти разновидности благородного корунда наряду с алмазами и изумрудом занимают высшее место в классификации драгоценных
- 20. Сапфир
- 21. Рубин
- 22. Соединения алюминия: Al2O3 – амфотерный оксид Оксид, который одновременно проявляет свойства и основного и кислотного оксидов.
- 24. Al2O3 – амфотерный оксид Основные свойства: Al2O3 + HCl − Кислотные свойства: Al2O3 + NaOH −
- 25. Соединения алюминия: Al(OH)3 – амфотерный гидроксид Гидроксид, который одновременно проявляет свойства и основания и кислоты.
- 26. Al(ОН)3 – амфотерный гидрооксид Основные свойства: Al(ОН)3 + HCl − Кислотные свойства: Al(ОН)3 + NaOH −
- 27. Применение алюминия. Из общемирового объема производимого алюминия 20% идет на строительство. Редкое здание сегодня возводится без
- 28. Применение алюминия. Чтобы создать современное транспортное средство, будь то автомобиль, поезд, океанский лайнер или космический корабль,
- 29. Применение алюминия. Из легкого металла делают вагоны суперскоростных поездов и современные вагоны метро. Транспорт Судостроители настолько
- 30. Применение алюминия. Первая алюминиевая банка для напитков появилась не так давно — в 1972 году. Тара
- 31. Применение алюминия. С 1926 года для усиления действия вакцин используют алюминиевые соли. Фармацевтика На основе алюминия
- 32. Применение алюминия. Алюминий прекрасно проводит электричество. Электрика и машиностроение С 1940-х годов алюминий почти полностью заменил
- 34. Скачать презентацию

![Нахождение в природе. Al Боксит Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3) Нефелины KNa3[AlSiO4]4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/128283/slide-2.jpg)




























 Применение спиртов
Применение спиртов Производство аммиака и азотной кислоты
Производство аммиака и азотной кислоты Курсовая работа. Оптимизация рецептуры вареных колбасных изделий по пищевым добавкам
Курсовая работа. Оптимизация рецептуры вареных колбасных изделий по пищевым добавкам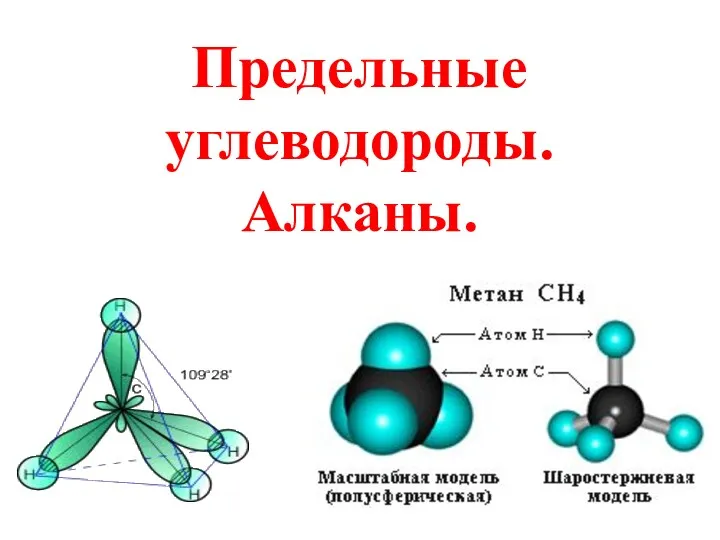 Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Амины. Номенклатура аминов
Амины. Номенклатура аминов Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс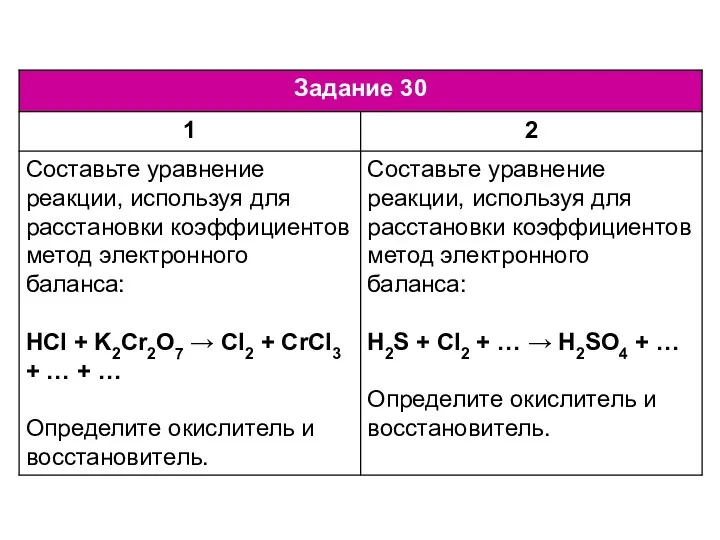 ЕГЭ по химии. Задание 30-34
ЕГЭ по химии. Задание 30-34 Галогенопроизводные углеводородов 1
Галогенопроизводные углеводородов 1 Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Анализ двойных диаграмм. Лабораторная работа
Анализ двойных диаграмм. Лабораторная работа Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Химический элемент титан
Химический элемент титан Минерал чароит. Месторождения
Минерал чароит. Месторождения Тұздар гидролизі
Тұздар гидролизі Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Строение атома. Строение электронных оболочек атомов
Строение атома. Строение электронных оболочек атомов Текстуры метаморфических пород
Текстуры метаморфических пород Ртуть и цинк
Ртуть и цинк АТФ Аденозинтрифосфат
АТФ Аденозинтрифосфат Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Вода. Растворимость, растворы
Вода. Растворимость, растворы Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс NaOH. Гидроксид натрия
NaOH. Гидроксид натрия Властивості і застосування каучуків. (Урок 15)
Властивості і застосування каучуків. (Урок 15) Водород и щелочные металлы
Водород и щелочные металлы Алкены – непредельные углеводороды. Получение, химические свойства и применение
Алкены – непредельные углеводороды. Получение, химические свойства и применение 20230306_gidroliz
20230306_gidroliz Интеллектуальная физико-химическая игра
Интеллектуальная физико-химическая игра