Содержание
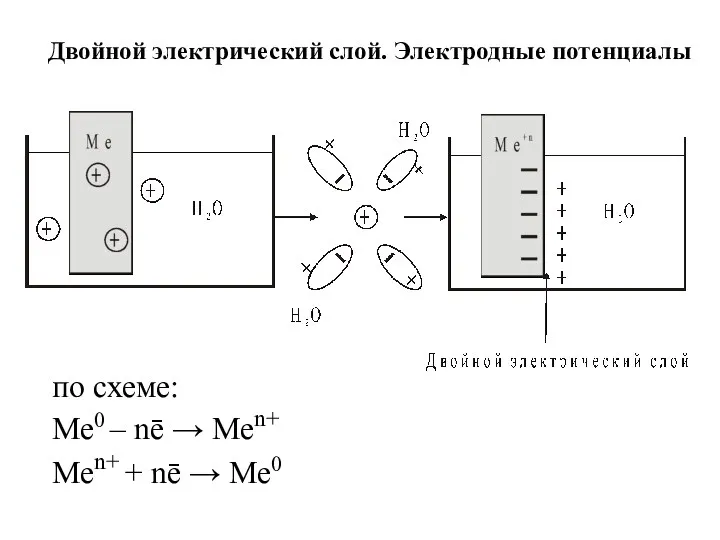
- 2. по схеме: Ме0 – nē → Меn+ Меn+ + nē → Ме0 Двойной электрический слой. Электродные
- 3. С течением времени устанавливается равновесие: Ме0 + mH2O ⇄ Me(H2O)mn+ + nē Ме0 ⇄ Меn++ nē
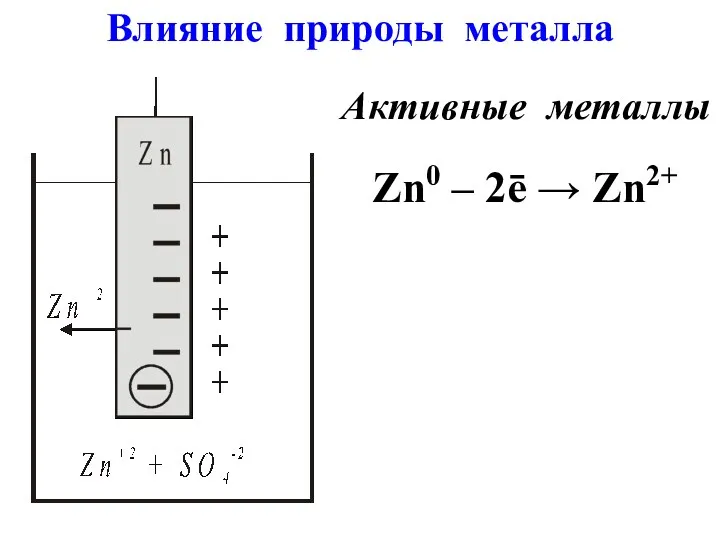
- 4. Активные металлы Zn0 – 2ē → Zn2+ Влияние природы металла
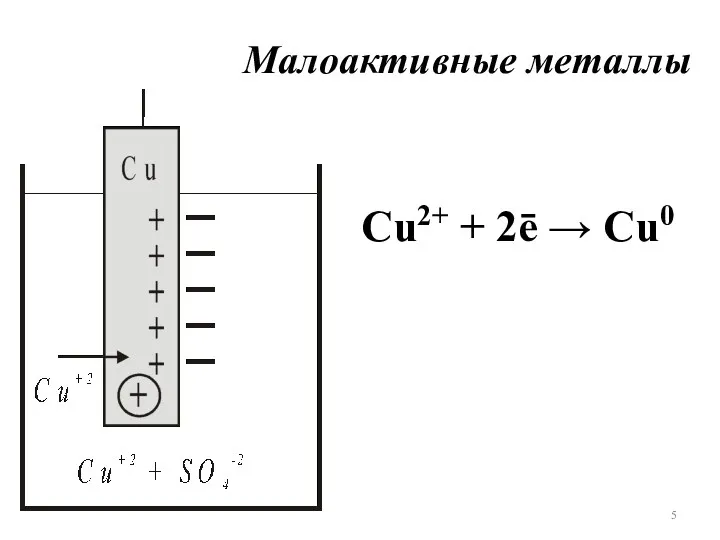
- 5. Малоактивные металлы Сu2+ + 2ē → Cu0
- 6. Электродный потенциал (Е, ϕ, [В]) Если концентрация ионов равна 1 моль/л при температуре 25оС, то электродный
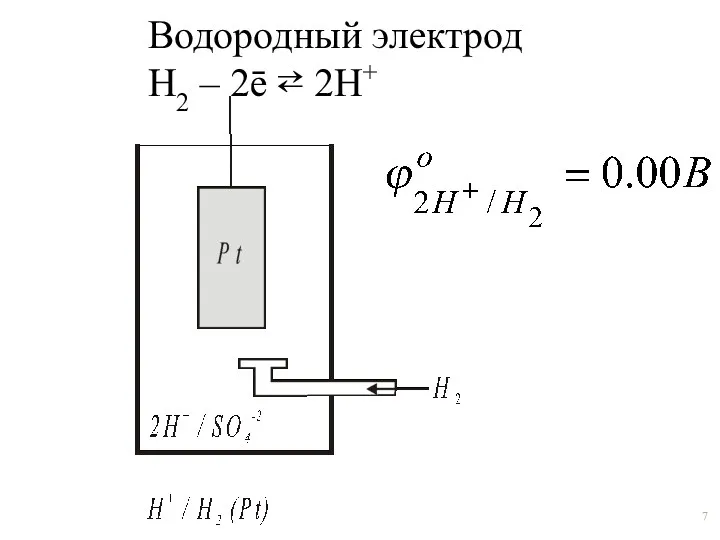
- 7. Водородный электрод Н2 – 2ē ⇄ 2Н+
- 8. Пример: Fe + CuCl2 = FeCl2 +Cu Cu + Hg(NO3)2 = Hg + Cu(NO3)2 Zn+2HCl=ZnCl2+H2
- 9. Таблица стандартных электродных потенциалов характеризует химическую активность металлов. 1. чем меньше электродный потенциал металла, тем больше
- 10. формула Нернста: ϕо – стандартный электродный потенциал (В); F – постоянная Фарадея (96500 Кл/экв);
- 11. R – универсальная газовая постоянная (8,314 Дж/моль); T – фактическая температура (298 К); n – число
- 12. Цинковая пластинка погружена в 0,01 М раствор её соли
- 13. Гальванические элементы (ГЭ)
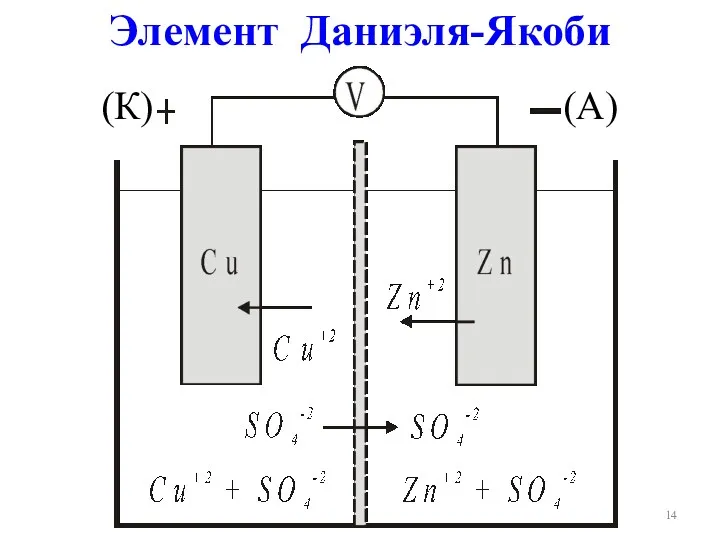
- 14. Элемент Даниэля-Якоби (К) (А)
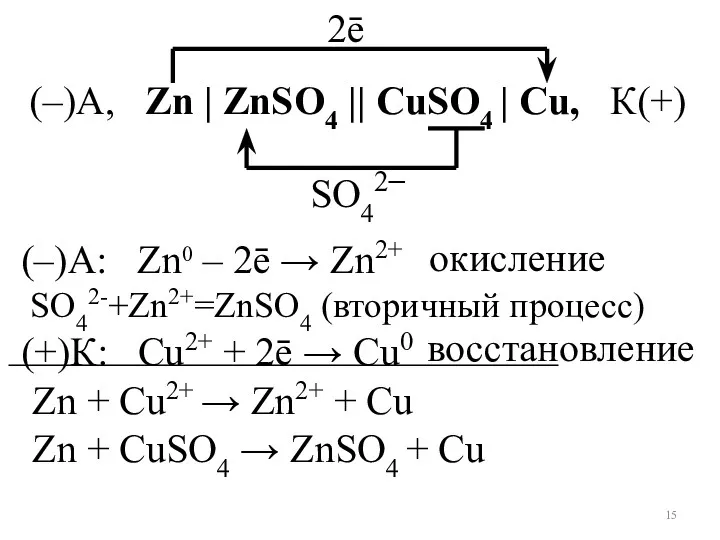
- 15. (–)А, Zn | ZnSO4 || CuSO4 | Cu, К(+) Zn + Сu2+ → Zn2+ + Cu
- 16. ЭДС = – Для элемента Даниэля-Якоби: ЭДС = – = 0,34 + 0,76 = 1,1 В
- 17. Формула Нернста ϕо – стандартный электродный потенциал (В); n – число отданных или принятых электронов; –
- 18. Пример: Цинковая пластинка погружена в 0,01 м раствор её соли.
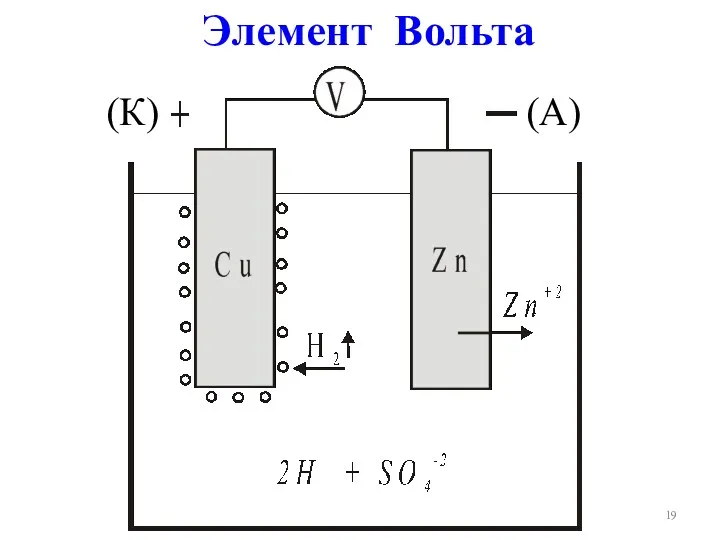
- 19. Элемент Вольта (К) (А)
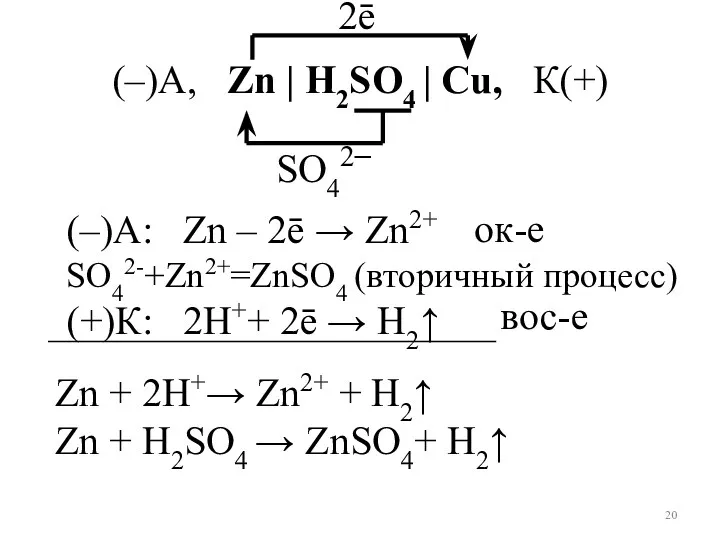
- 20. (–)А: Zn – 2ē → Zn2+ SO42-+Zn2+=ZnSO4 (вторичный процесс) (+)К: 2Н++ 2ē → Н2↑ Zn +
- 21. ЭДС = – = 0,34 + 0,76 = 1,1 В =
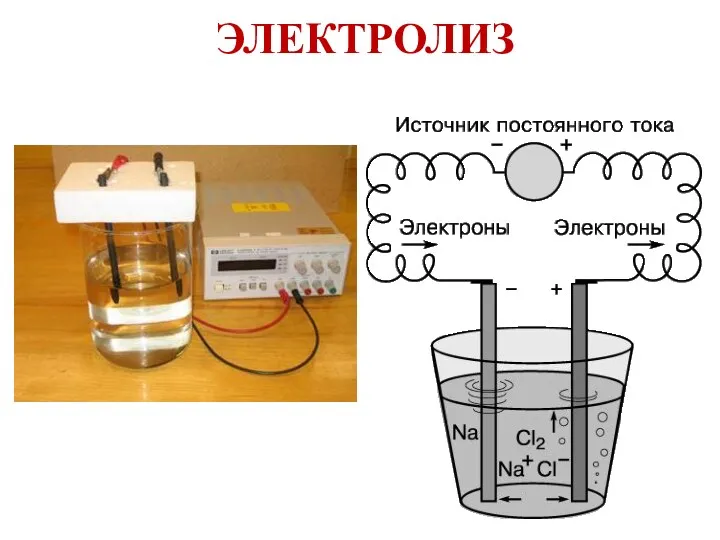
- 22. ЭЛЕКТРОЛИЗ
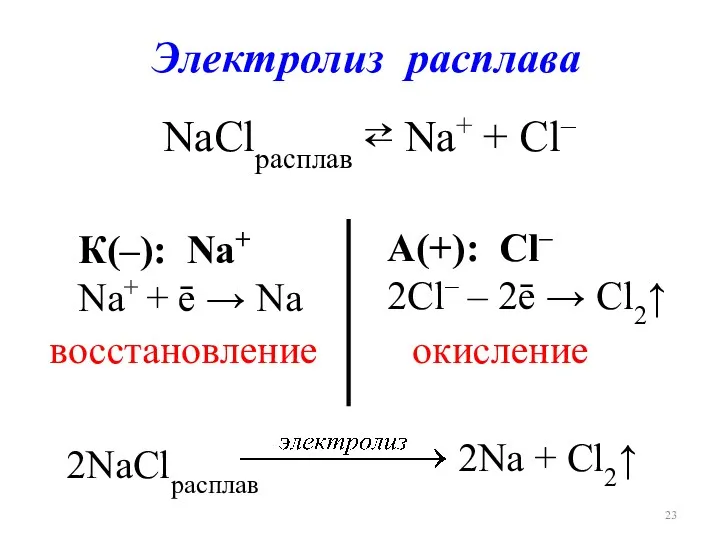
- 23. Электролиз расплава NaClрасплав ⇄ Na+ + Cl– К(–): Na+ Na+ + ē → Na А(+): Cl–
- 24. Na2SO4 расплав ⇄ 2Na+ + SO4–2 К (–): Na+ Na++ ē→Na А (+): SO4–2 SO4–2– 2ē
- 25. Электролиз водных растворов
- 26. Последовательность разрядки ионов и молекул на электродах 1) На катоде: в первую очередь разряжается (восстанавливается) ион
- 28. 2) На аноде: окисляются более сильные восстановители – вещества, имеющие меньшее значение потенциала. SO42– OH– (H2O)
- 30. Электролиз водного раствора йодида калия с инертными электродами KI ⇄ K+ + I– К(–): K+; H+(H2O)
- 31. Электролиз водного раствора иодида калия с инертными электродами KI ⇄ K+ + I– Суммарный процесс (сокращенный
- 32. Na2SO4 ⇄ 2Na+ + SO42– К(–): Na+, H+(H2O) –3 А(+): SO42–, OH–(H2O) +2.05 > +1.4 ϕо
- 33. Na2SO4 ⇄ 2Na+ + SO42– Электролиз водного раствора Na2SO4 с инертными электродами H2O ⇄ H+ +
- 34. NiSO4 ⇄ Ni2+ + SO42– К(–): Ni2+, H+(H2O) –0,25 > -0,41 А(+): SO42–, OH–(H2O) +2.05 >
- 35. NiSO4 ⇄ Ni2+ + SO42– К(–): Ni2+, H+(H2O) –0,25 А(+): SO42–, OH–, Ni0 +2.05>+1.4>–0,25 ϕо 2H2O
- 36. Законы электролиза I закон Фарадея m = kQ m – количество вещества, г; k – электрохимический
- 37. Q = Iτ I – сила тока, А; τ – время, с. m = kIτ
- 38. Мэ – молярная масса эквивалента металла, г/моль; I – сила тока, А; F – число Фарадея
- 39. для газов: VЭ(O2) = 5,6 л/моль VЭ(H2,Cl2) = 11,2 л/моль
- 40. II закон Фарадея m1 : m2 : … : mn = ЭМ1 : ЭМ2 : …
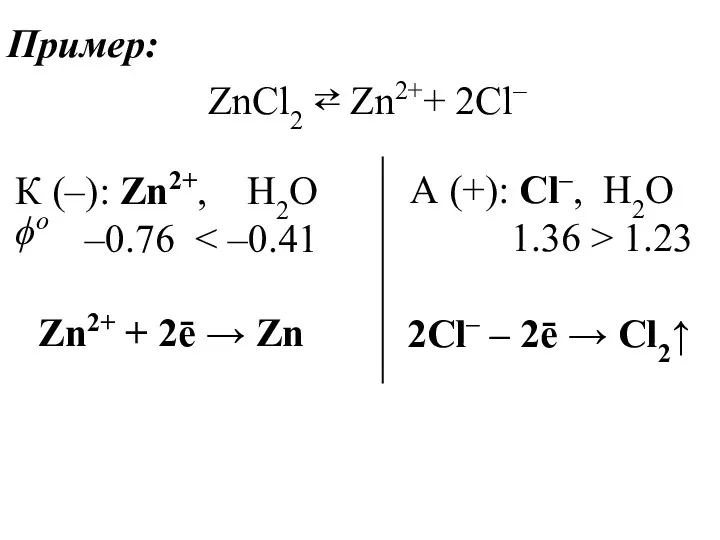
- 41. Пример: ZnCl2 ⇄ Zn2++ 2Cl– К (–): Zn2+, H2O –0.76 А (+): Cl–, H2O 1.36 >
- 42. mZn = ⇒
- 44. Скачать презентацию

![Электродный потенциал (Е, ϕ, [В]) Если концентрация ионов равна 1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/588206/slide-5.jpg)




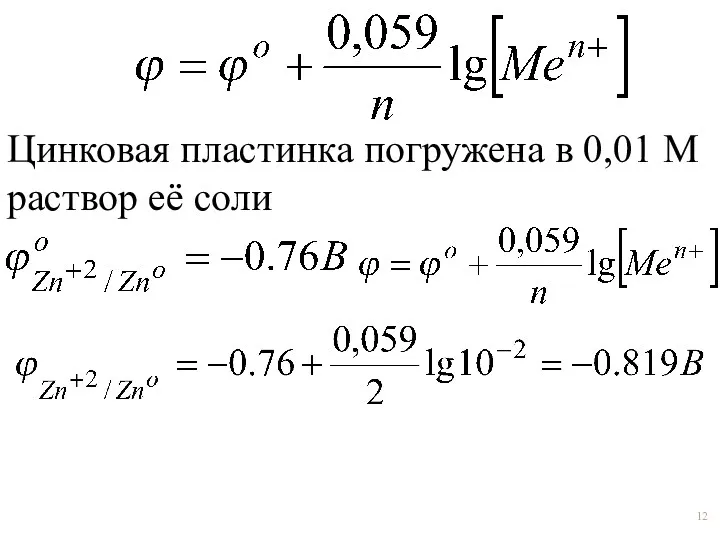




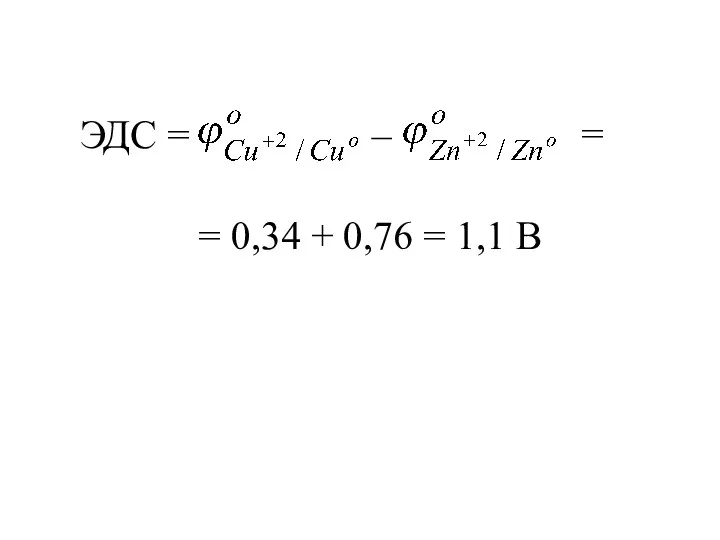















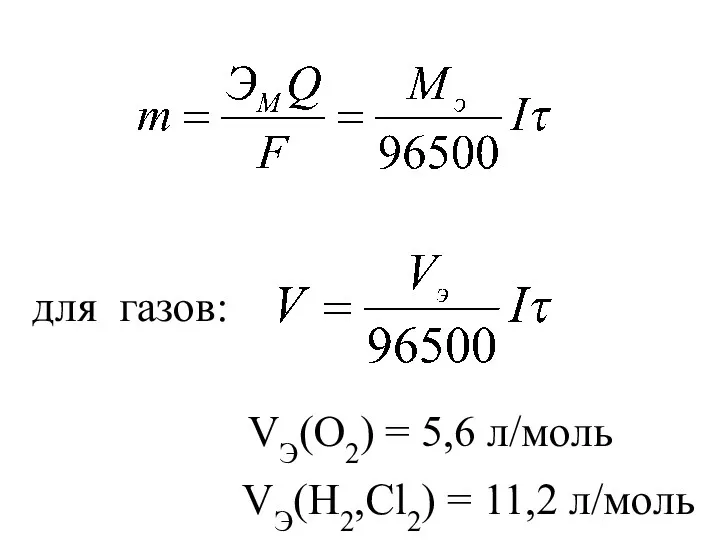

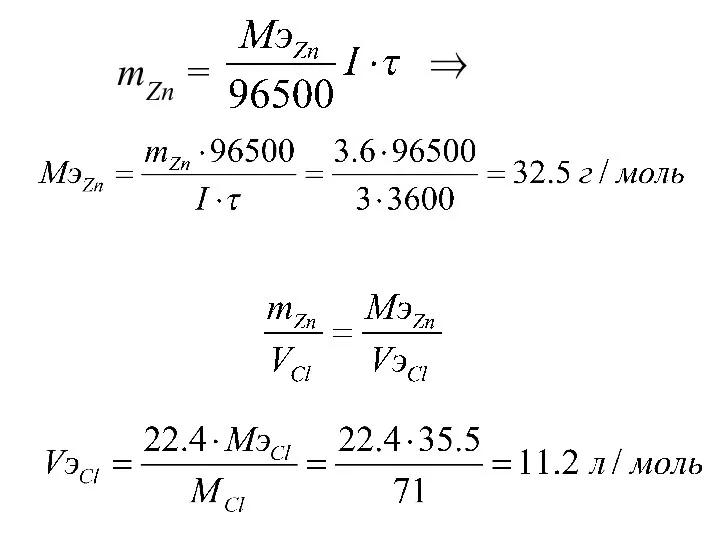
 Фенолдар. Физикалық қасиеттері
Фенолдар. Физикалық қасиеттері Многоэлектронный атом
Многоэлектронный атом Нанопористые материалы
Нанопористые материалы химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя
химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя Ерітінді - еқі немесе бірнеше қомпоненттен тұратын гомогенді система
Ерітінді - еқі немесе бірнеше қомпоненттен тұратын гомогенді система Химиядан сұрақтар
Химиядан сұрақтар Правила техники безопасности при работе в химическом кабинете
Правила техники безопасности при работе в химическом кабинете Альдольные реакции енолятов
Альдольные реакции енолятов Основні класи неорганічних сполук
Основні класи неорганічних сполук Көміртек
Көміртек Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Соли и их свойства
Соли и их свойства Основные классы неорганических соединений
Основные классы неорганических соединений Водород. Растворы. 8 класс
Водород. Растворы. 8 класс Методы окислительно-восстановительного титрования (Редоксиметрия)
Методы окислительно-восстановительного титрования (Редоксиметрия) Ветеринариялық гигиена және санитария
Ветеринариялық гигиена және санитария Распознавание химических соединений
Распознавание химических соединений Д. И. Менделеев человек - загадка
Д. И. Менделеев человек - загадка Процесс в химическом реакторе
Процесс в химическом реакторе Химические свойства металлов
Химические свойства металлов Спирты. Классификация
Спирты. Классификация Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья
Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья Сероводород и сульфиды
Сероводород и сульфиды Щёлочноземельные металлы
Щёлочноземельные металлы Алканы
Алканы Термический анализ
Термический анализ Реактор получения элементарной серы
Реактор получения элементарной серы Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6)