Содержание
- 2. Принцип Паули В кванто - химических расчетах полную волновую функцию задают иным образом – виде спин
- 3. Принцип Паули Для атома Не имеет 2 электрона на 2-х АО 1s0 Обозначение σ(ms): ↑α m=1/2;
- 4. Правила заполнения электронов по АО Принцип водородоподопия, т.е. электроны во многоэлектронных атомах М заполняются также, как
- 5. Правила Хунда (Выбор основного терма с Emin) E ~ Т = f (S, L, J) 1
- 6. Правила Хунда 3 - При равных значениях S и L терму с мин. энергии отвечает 3.1
- 7. Примеры записи термов основного состояния L = ⏐Σm⏐ Символ терма S P D F G H
- 8. Микросостояния электронов в С Электронная конфигурация атома углерода 1s22s22p2 Рассмотреть расположения 2-х р - эл-нов. __↑__
- 9. Правила заполнения вырожденных уровней в атоме 1. Вырожденные уровни заполняются начиная с АО с max значением
- 10. Спин-орбитальное квантовое число L-S связь (связь Рассел-Саундерса) Ряды Клебша -Гордона: J = L+S, L+S -1, ……,
- 11. Общее число вырожденных состояний для терма gJ = (2L + 1)(2S + 1) 1S L =0;
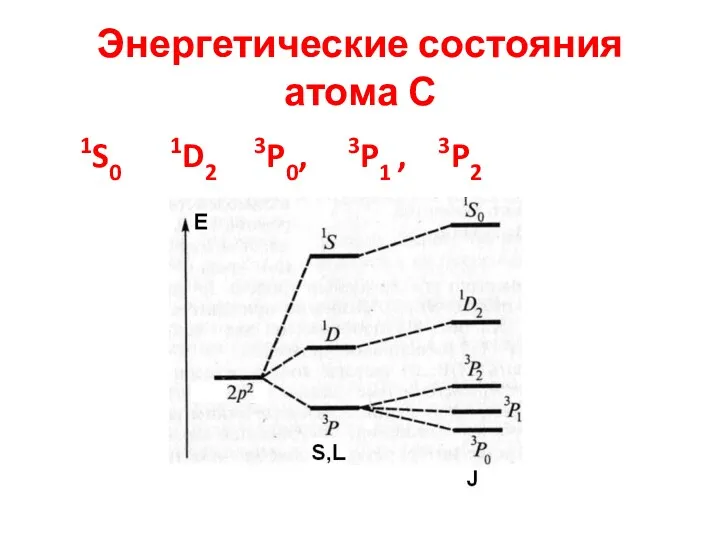
- 12. Энергетические состояния атома С 1S0 1D2 3P0, 3P1 , 3P2
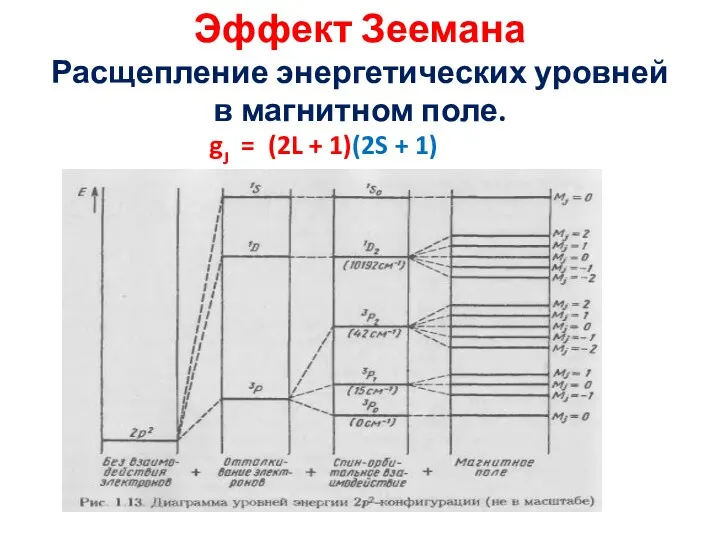
- 13. Эффект Зеемана Расщепление энергетических уровней в магнитном поле. gJ = (2L + 1)(2S + 1)
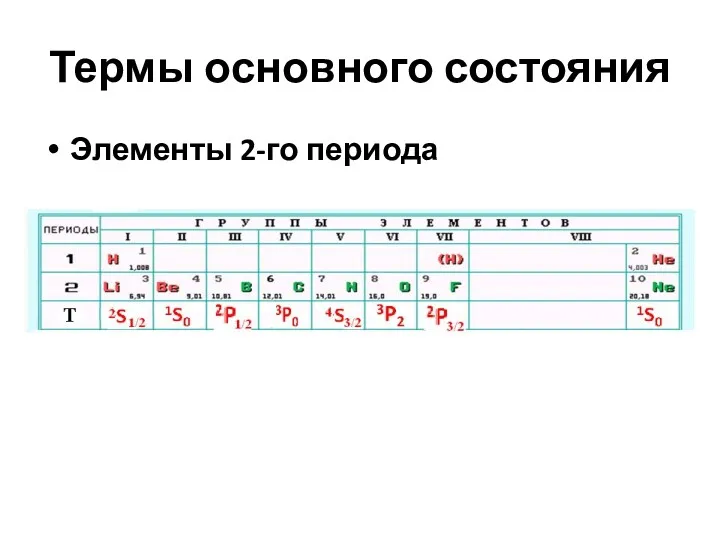
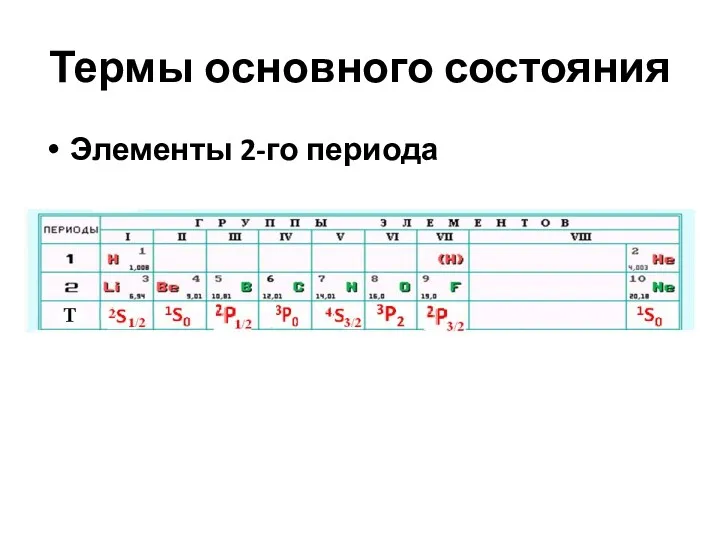
- 15. Термы основного состояния Элементы 2-го периода
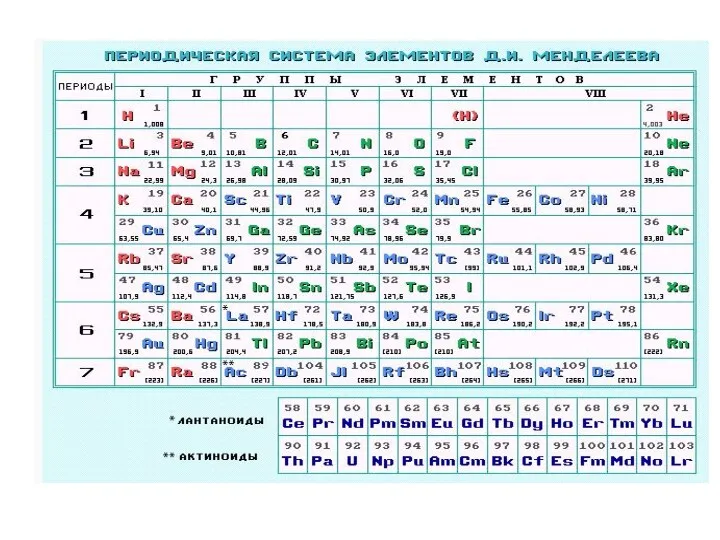
- 16. Периодическая система элементов. Период это квант. оболочка с n = const. Каждый период начинается с атома
- 17. Периодическая система элементов. 4 Магнитные свойства атомов. При наличие неспаренных электронов - атом парамагнетик и в
- 19. Термы основного состояния Элементы 2-го периода
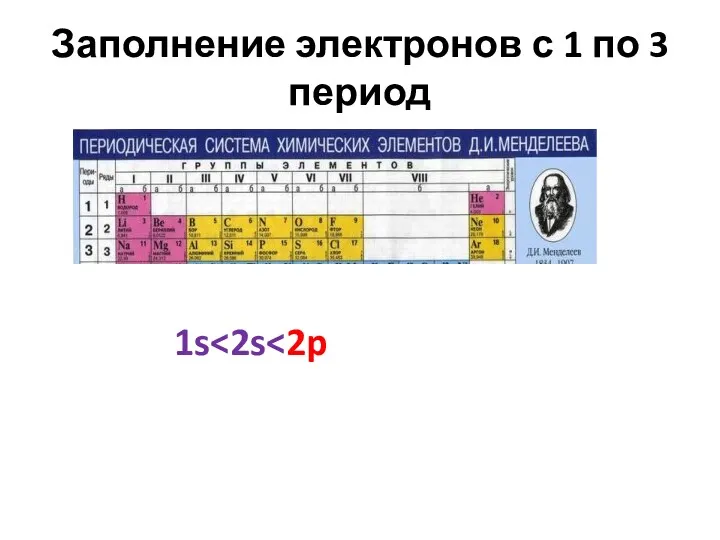
- 20. Заполнение электронов с 1 по 3 период 1s
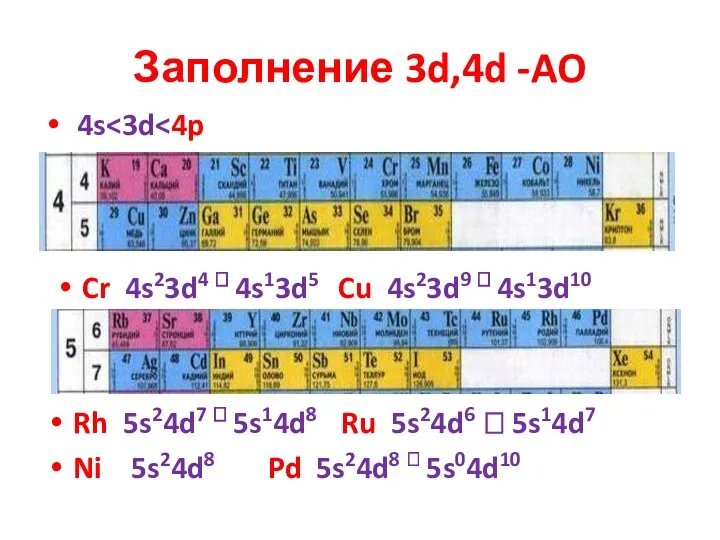
- 21. Заполнение 3d,4d -AO 4s Cr 4s23d4 ? 4s13d5 Cu 4s23d9 ? 4s13d10 Rh 5s24d7 ? 5s14d8
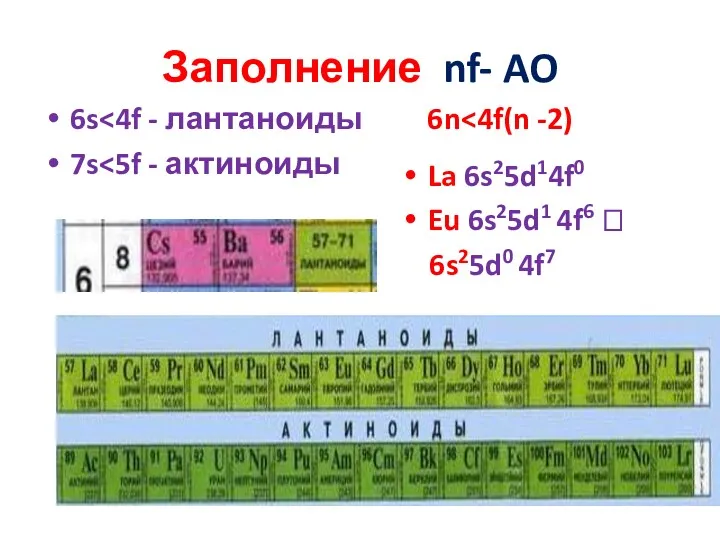
- 22. Заполнение nf- AO 6s 7s La 6s25d14f0 Eu 6s25d1 4f6 ? 6s25d0 4f7
- 23. Возбужденное состояние атома Если электрон переходит с одной АО на другую с большей Е, то такое
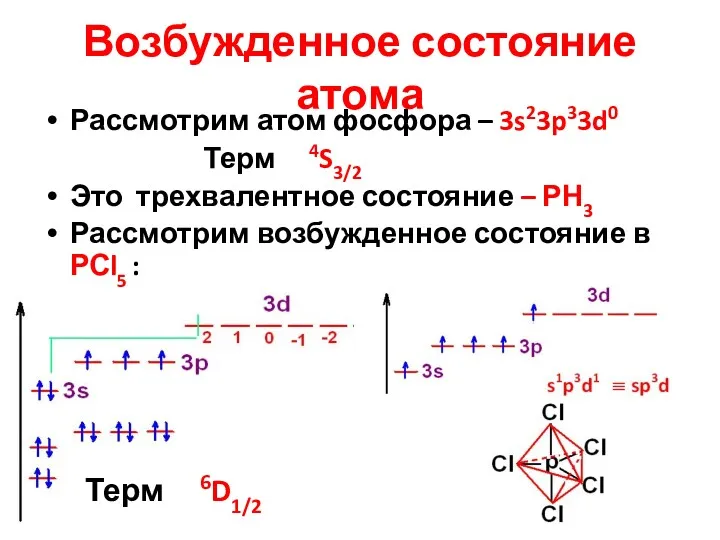
- 24. Возбужденное состояние атома Рассмотрим атом фосфора – 3s23p33d0 Терм 4S3/2 Это трехвалентное состояние – РН3 Рассмотрим
- 25. Потенциал ионизации (I) Удаление на бесконечно большое рас-стояние первого электрона – называют первым вертикальным потенциалом ионизации
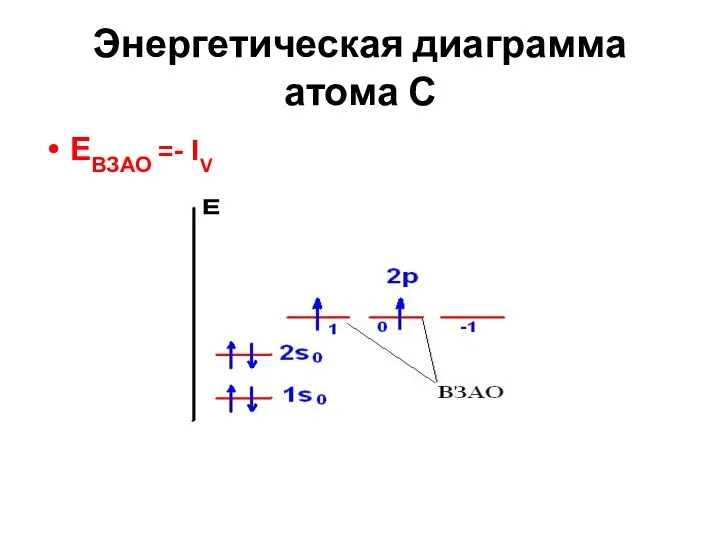
- 26. Энергетическая диаграмма атома С ЕВЗАО =- IV
- 27. Сродство к электрону (ЕА) B(г) + е ? B-(г) + EA
- 28. Электроотрицательность атома Электроотрицательность χp - это их способность к притяжению валентных электронов , т.е. смещение электронного
- 29. Электроотрицательность атома Необходимо постулировать значение χP одного из элементов ? χP,Н =0 Полинг в 1939 г
- 30. Электроотрицательность атома В настоящее время находит применение и шкала Оллреда –Рохова 1958 г. χOR = c(Z*-d)/r2
- 32. Скачать презентацию


















 Основи. Склад, назви, класифікація, використання
Основи. Склад, назви, класифікація, використання Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Тепловой эффект химической реакции
Тепловой эффект химической реакции Переходные элементы
Переходные элементы Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Химическая связь
Химическая связь Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Хімічні властивості кислот
Хімічні властивості кислот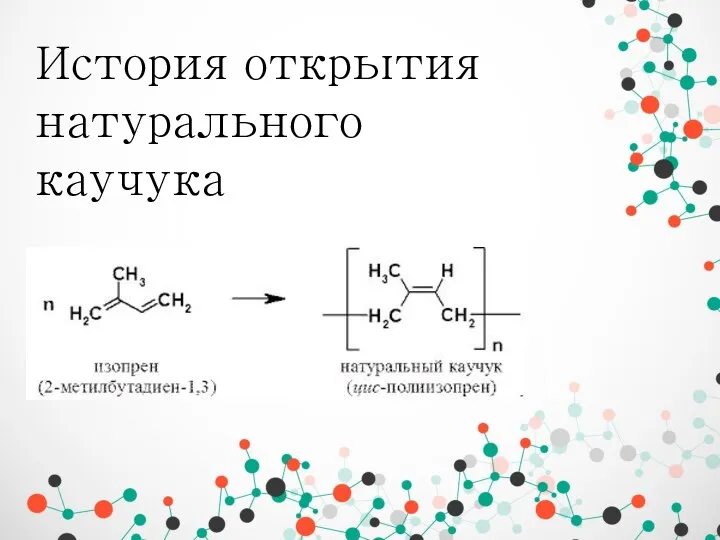 История открытия натурального каучука
История открытия натурального каучука Минералогический состав почв
Минералогический состав почв Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Химический элемент радий
Химический элемент радий Ask the right question to find the best answer
Ask the right question to find the best answer Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Водород
Водород Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Серная кислота
Серная кислота Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини
Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН Щелочи
Щелочи Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Перманганат калия
Перманганат калия Химическая промышленность Донецкой области
Химическая промышленность Донецкой области