Содержание
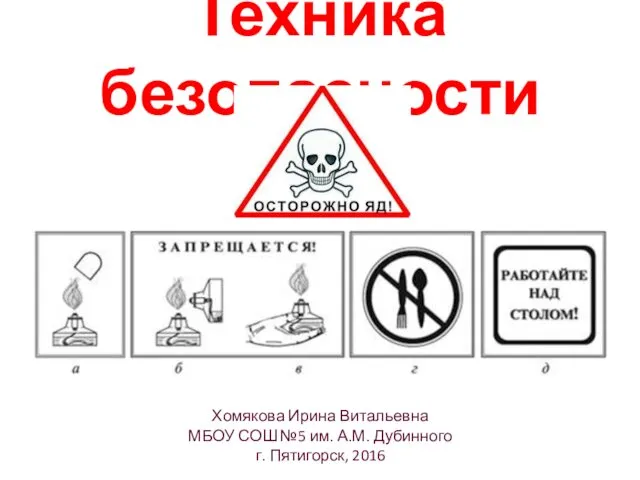
- 2. Техника безопасности Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016
- 3. Задание Лаборант, разлив по склянкам растворы кислот: HCl, H2SO4 и H3PO4, обнаружил, что забыл наклеить на
- 4. ~0,1 M HCl ~0,05 M H2SO4 ~0,05 M H3PO4 ~0,1 M BaCl2 ~0,1 M NaOH 0,0500
- 5. ~0,1 M HCl ~0,05 M H2SO4 ~0,05 M H3PO4 ~0,1 M BaCl2 ~0,1 M NaOH 0,0500
- 6. Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016 Реактивы и оборудование
- 7. 1. В три пробирки переносим глазной пипеткой по 10–15 капель растворов кислот. 2. В каждую пробирку
- 8. Качественная реакция на SO42- Pb2+ + 2Cl- = PbCl2↓ Hg22+ + 2Cl- = Hg2Cl2↓ Pb2+ +
- 9. Уравнения реакций Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016 H2SO4 +
- 10. Стандартизация раствора NaOH Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016 С
- 11. Стандартизация раствора NaOH Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016 Расчёт
- 12. Определение концентрации H2SO4 Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016 Заполняем
- 13. Определение концентрации H2SO4 Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016 Расчёт
- 14. Оформление результатов Хомякова Ирина Витальевна МБОУ СОШ №5 им. А.М. Дубинного г. Пятигорск, 2016 Определение кислот
- 16. Скачать презентацию











 Гидроксипроизводные углеводородов. Спирты. Фенолы
Гидроксипроизводные углеводородов. Спирты. Фенолы Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі Табиғи нанокристалдар
Табиғи нанокристалдар Соли. Определение солей
Соли. Определение солей Класифікація та властивості оксидів
Класифікація та властивості оксидів Кристаллы. Формы
Кристаллы. Формы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Растворы электролитов
Растворы электролитов Общая химия.(Лекция№1). Основные законы и понятия химии
Общая химия.(Лекция№1). Основные законы и понятия химии Фосфор. Урок в 9 классе
Фосфор. Урок в 9 классе Основания. Обобщение
Основания. Обобщение Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Нефть и ее роль в мировой экономике
Нефть и ее роль в мировой экономике Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Кривые титрования: построение и анализ (лекция 6)
Кривые титрования: построение и анализ (лекция 6)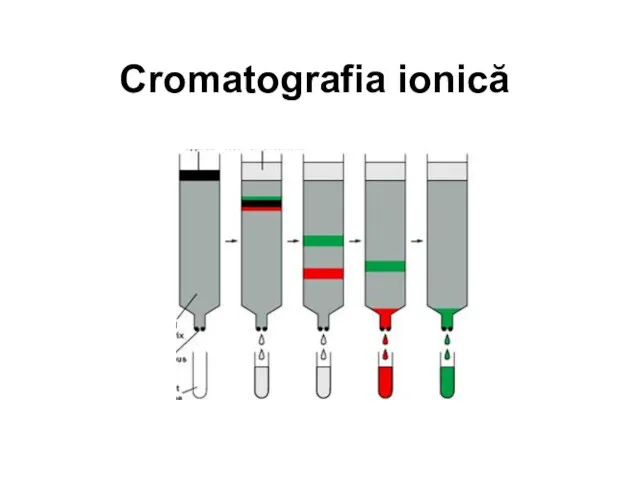 Cromatografia ionică
Cromatografia ionică Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса
Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан
Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан Вода. Состав и строение молекулы
Вода. Состав и строение молекулы Негізгі топша элементтерінің химиясы
Негізгі топша элементтерінің химиясы Виды химической связи
Виды химической связи Одноатомные спирты. Простые эфиры
Одноатомные спирты. Простые эфиры Органическая химия в ряду других наук
Органическая химия в ряду других наук Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах
Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах Періодична система хімічних елементів. Хімія. 8 клас
Періодична система хімічних елементів. Хімія. 8 клас Жидкие кристаллы
Жидкие кристаллы