Содержание
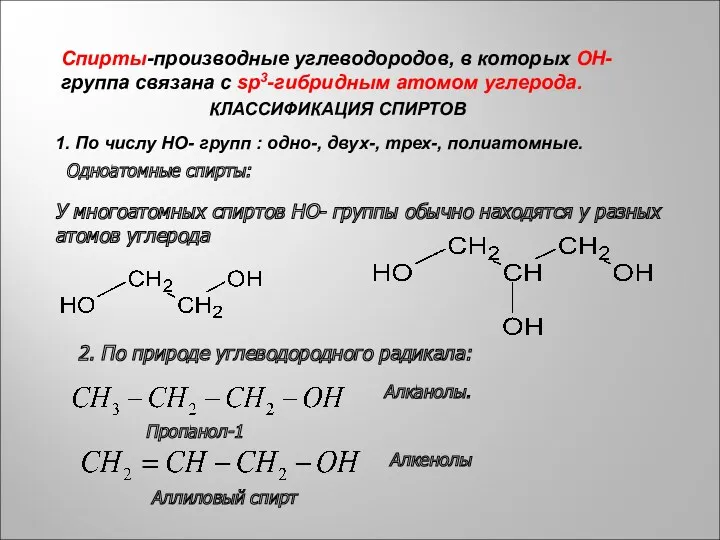
- 2. КЛАССИФИКАЦИЯ СПИРТОВ 1. По числу НО- групп : одно-, двух-, трех-, полиатомные. Одноатомные спирты: У многоатомных
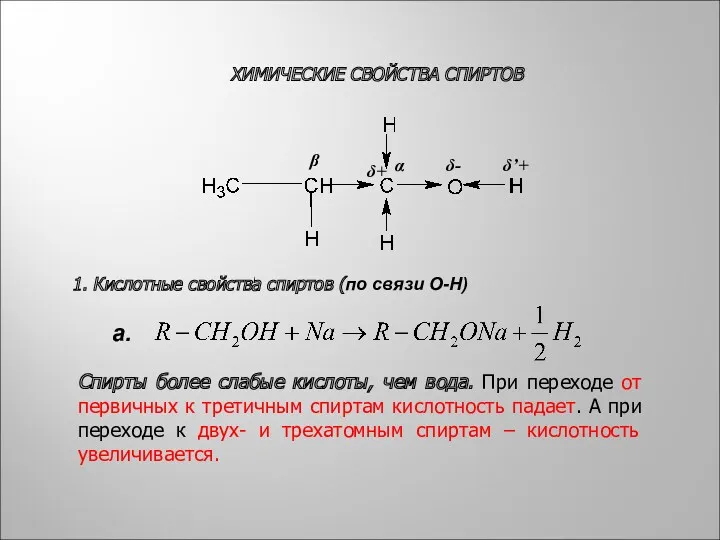
- 3. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ δ+ δ- α β δ’+ 1. Кислотные свойства спиртов (по связи О-Н) Спирты
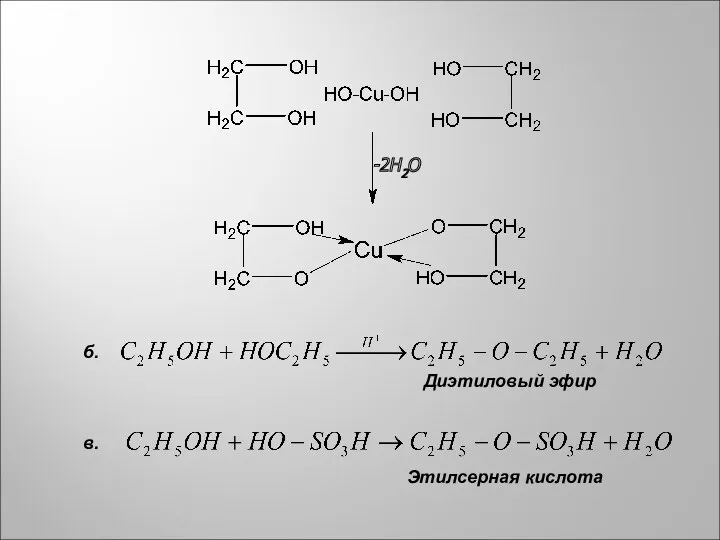
- 4. -2H2O б. в. Этилсерная кислота Диэтиловый эфир
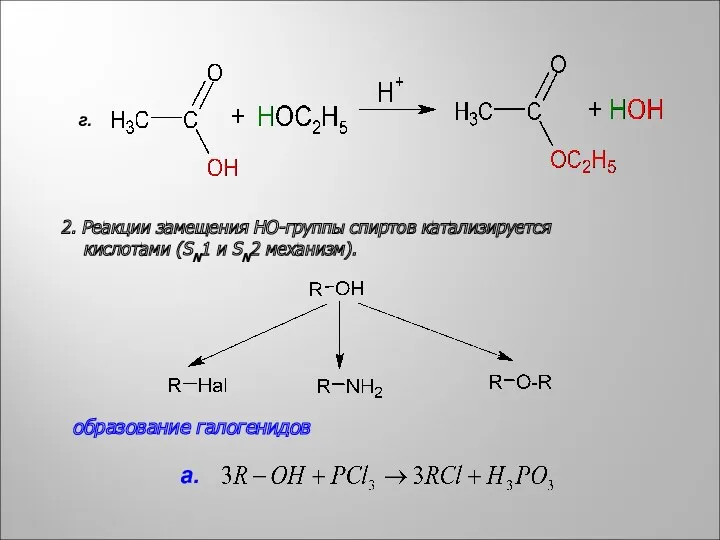
- 5. 2. Реакции замещения HO-группы спиртов катализируется кислотами (SN1 и SN2 механизм). образование галогенидов г. а.
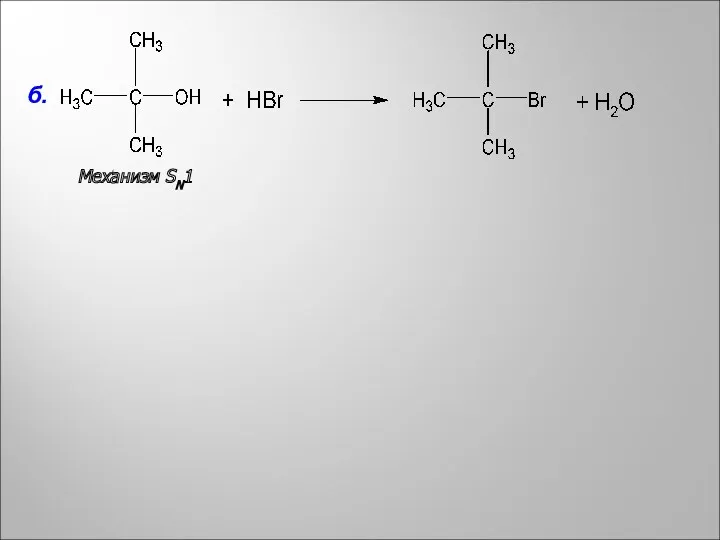
- 6. Механизм SN1 б.
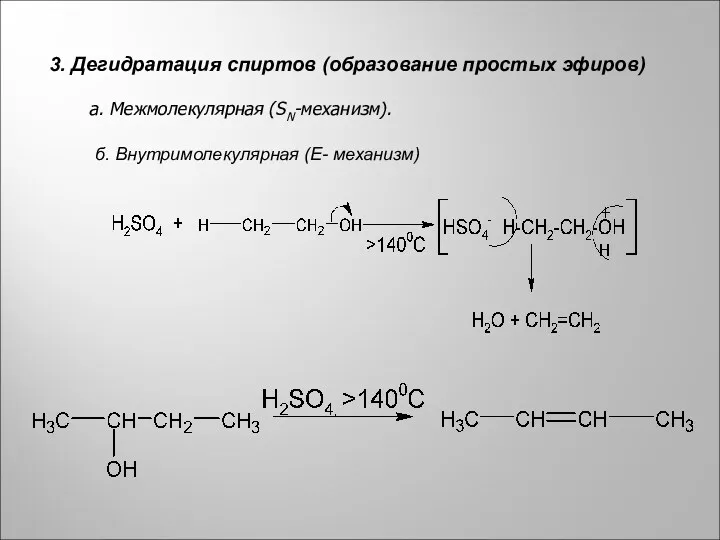
- 7. 3. Дегидратация спиртов (образование простых эфиров) а. Межмолекулярная (SN-механизм). б. Внутримолекулярная (E- механизм)
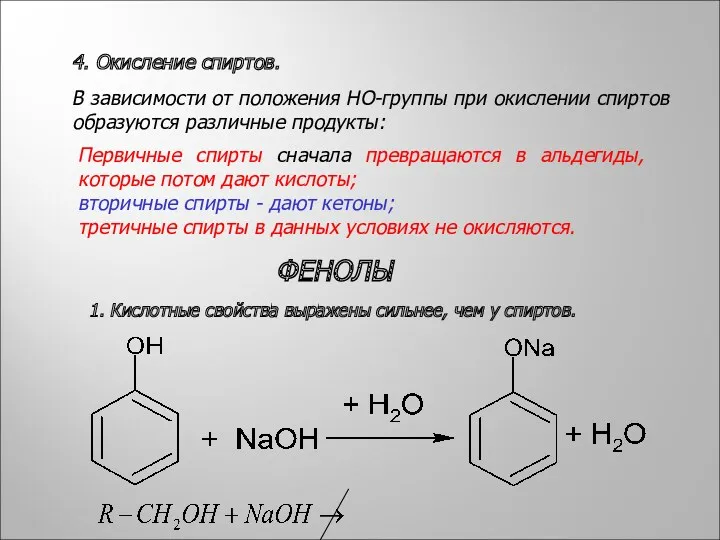
- 8. 4. Окисление спиртов. В зависимости от положения HO-группы при окислении спиртов образуются различные продукты: Первичные спирты
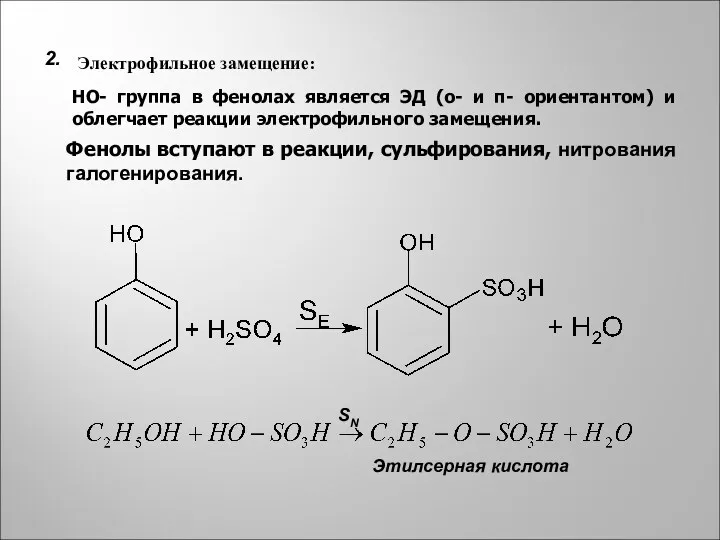
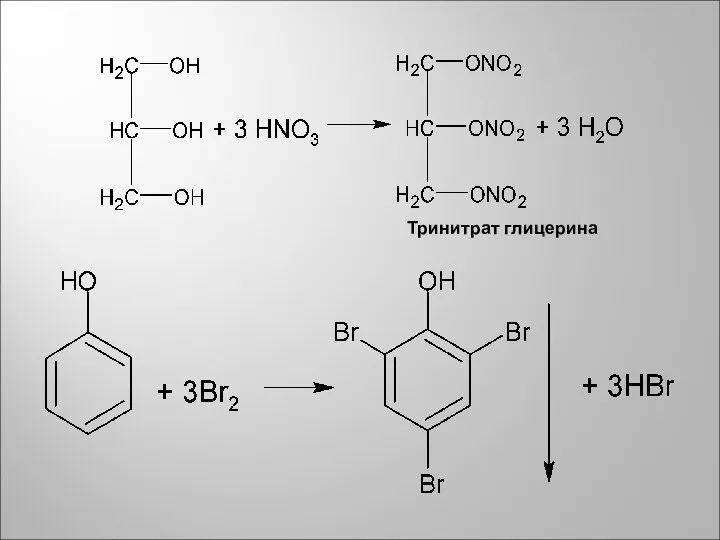
- 9. 2. Этилсерная кислота SN Электрофильное замещение: HO- группа в фенолах является ЭД (о- и п- ориентантом)
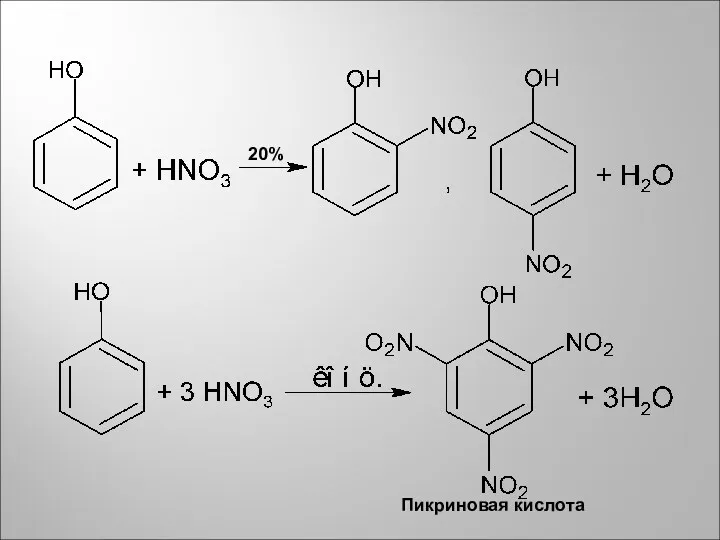
- 10. 20% Пикриновая кислота
- 11. Тринитрат глицерина
- 12. 3. 4.
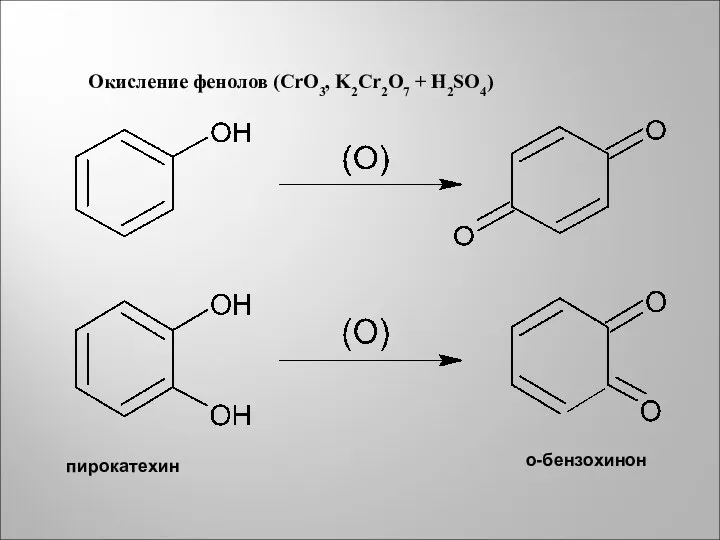
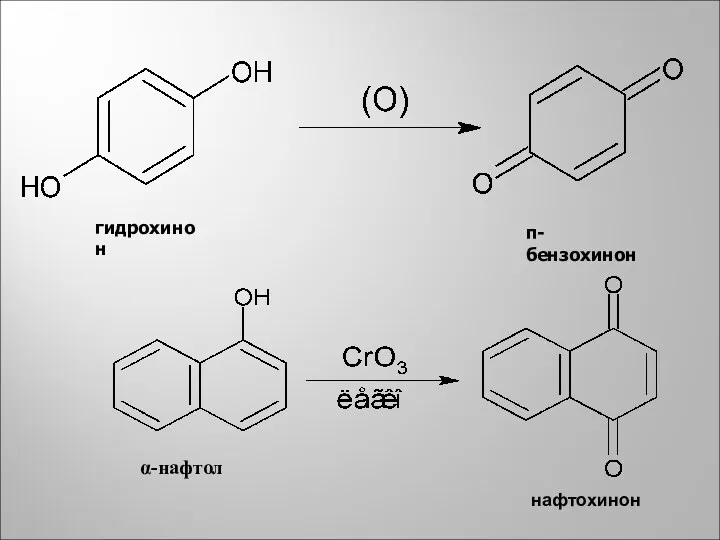
- 13. Окисление фенолов (CrO3, K2Cr2O7 + H2SO4) пирокатехин о-бензохинон
- 14. гидрохинон п-бензохинон α-нафтол нафтохинон
- 15. Кислотно-основные свойства органических соединений Кислотность и основность – важнейшие понятия, которые определяют многие свойства и биологическую
- 16. ТЕОРИЯ БРЕНСТЕДА-ЛОУРИ Эта теория связана с переносом протона, Н+ (протолитическая теория). Кислоты – вещества, которые в
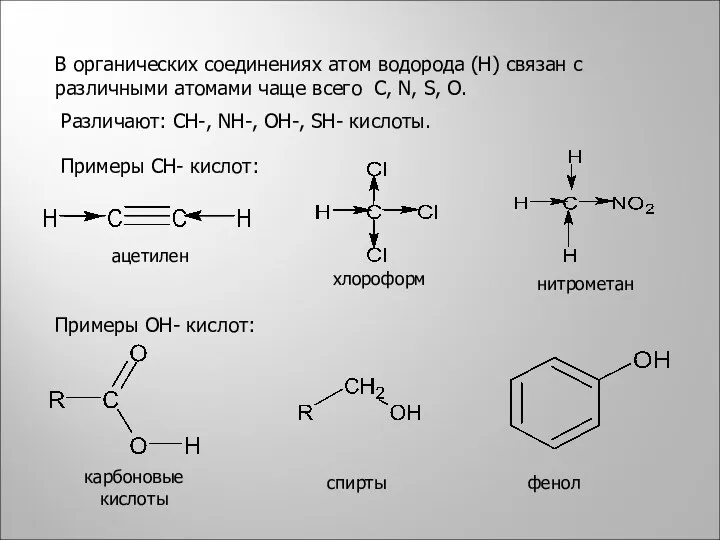
- 17. В органических соединениях атом водорода (Н) связан с различными атомами чаще всего С, N, S, O.
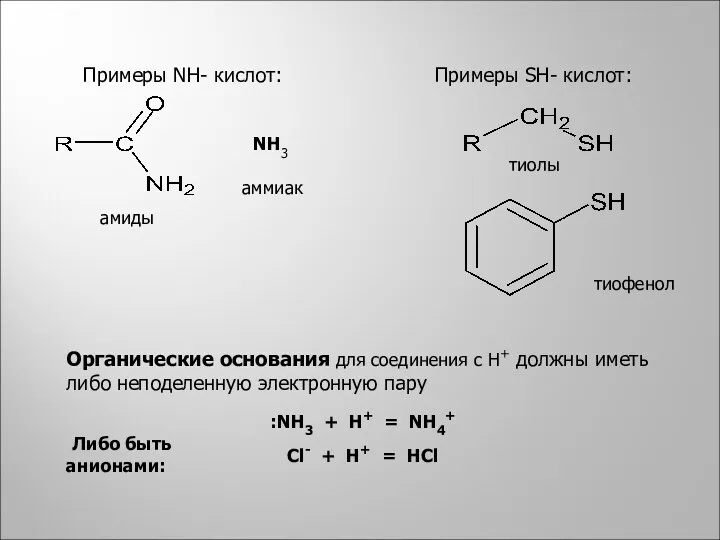
- 18. Примеры NН- кислот: NH3 амиды аммиак Примеры SН- кислот: тиолы тиофенол Органические основания для соединения с
- 19. Т.к. органических соединений много и не все они растворимы в воде или других полярных растворителях (например,
- 20. 1. Природа атома в кислотном центре. Этот фактор связан с поляризуемостью и электроотрицательностью элемента в кислотном
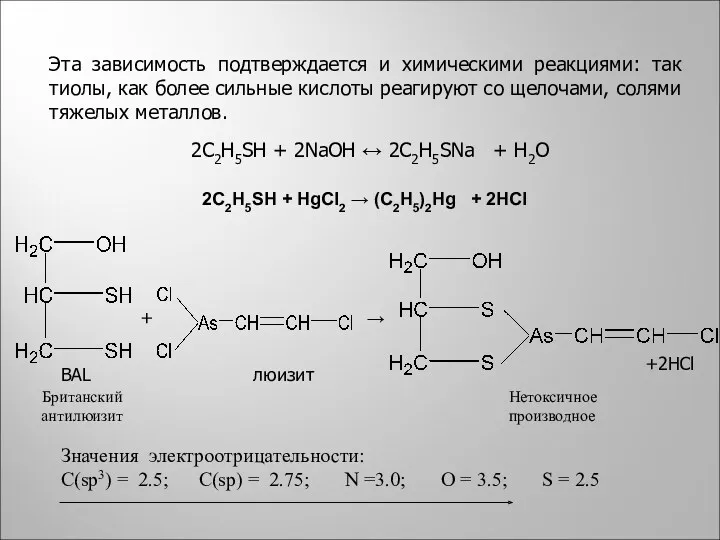
- 21. Эта зависимость подтверждается и химическими реакциями: так тиолы, как более сильные кислоты реагируют со щелочами, солями
- 22. Чем более электроотрицательным является элемент в кислотном центре, тем прочнее он несет отрицательный заряд и тем
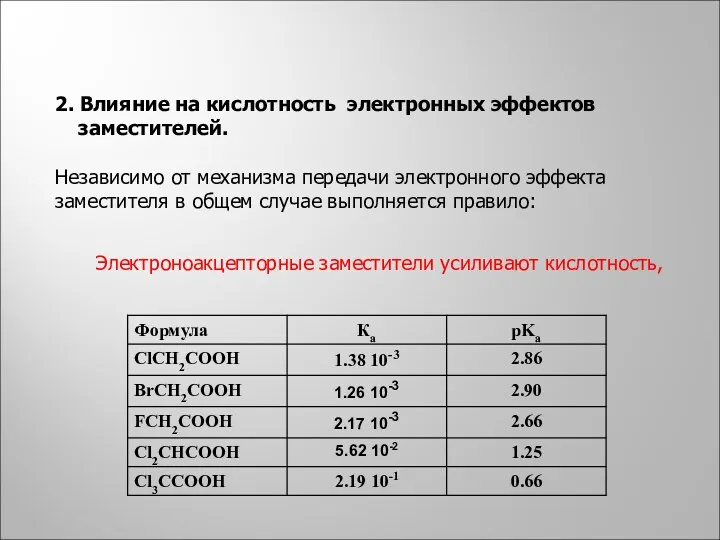
- 23. 2. Влияние на кислотность электронных эффектов заместителей. Независимо от механизма передачи электронного эффекта заместителя в общем
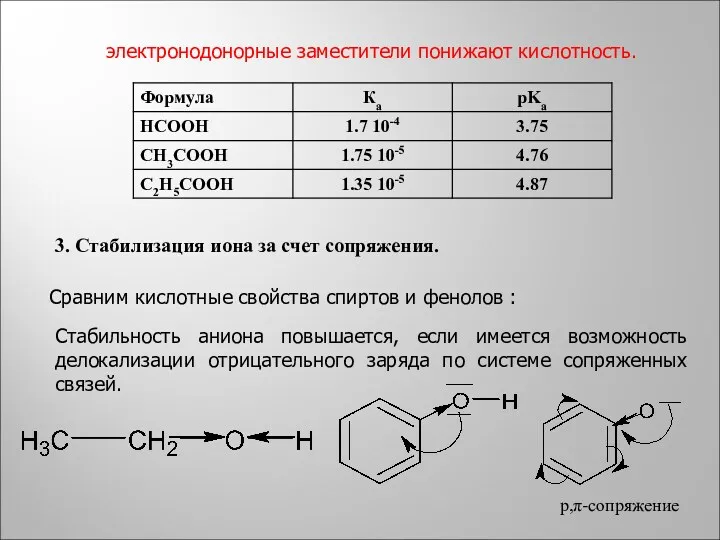
- 24. электронодонорные заместители понижают кислотность. 3. Стабилизация иона за счет сопряжения. Сравним кислотные свойства спиртов и фенолов
- 26. Скачать презентацию
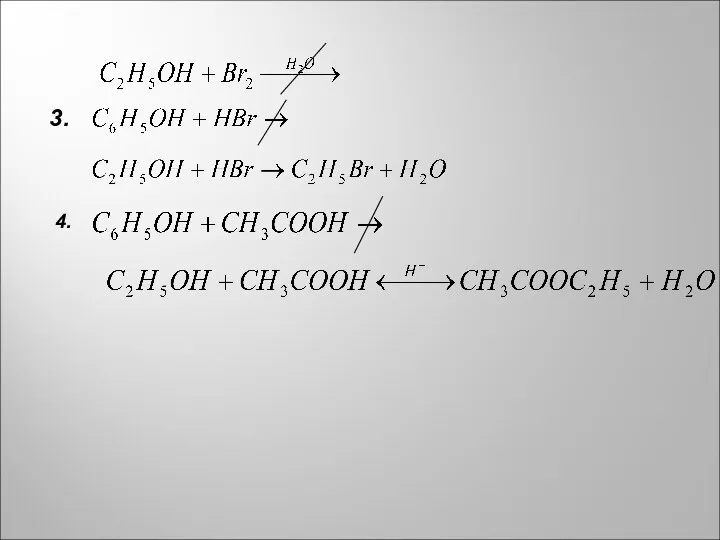





 Задания С 3 для подготовки к ГИА -9 по химии
Задания С 3 для подготовки к ГИА -9 по химии Общая характеристика халькогенов. Кислород
Общая характеристика халькогенов. Кислород Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении
Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении Алкины
Алкины Простые вещества — металлы и неметаллы
Простые вещества — металлы и неметаллы Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Предельные и непредельные углеводороды
Предельные и непредельные углеводороды Органическая химия. Лекция 13
Органическая химия. Лекция 13 Элементы VIА группы
Элементы VIА группы Р-элементы IV А группы. Углерод и кремний
Р-элементы IV А группы. Углерод и кремний Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Решение задачи №10. Гидроксид рубидия. Команда Карбораны
Решение задачи №10. Гидроксид рубидия. Команда Карбораны Общие сведения о месторождениях полезных ископаемых
Общие сведения о месторождениях полезных ископаемых Гетероатомные соединения нефти
Гетероатомные соединения нефти Вирощування кристалів в додомашніх умовах
Вирощування кристалів в додомашніх умовах Электрохимические методы. Кондуктометрия в анализе объектов окружающей среды
Электрохимические методы. Кондуктометрия в анализе объектов окружающей среды Электроизоляционные пластмассы
Электроизоляционные пластмассы Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений
Агрегатные состояния вещества с точки зрения атомно-молекулярных представлений Крахмал. Физические свойства
Крахмал. Физические свойства Химия и сельское хозяйство
Химия и сельское хозяйство Нефть. Свойства нефти
Нефть. Свойства нефти Петрология. Классификации магматических горных пород
Петрология. Классификации магматических горных пород Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Золото и серебро
Золото и серебро Лекция 6. Растворы электролитов
Лекция 6. Растворы электролитов Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть
Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15