Содержание
- 2. Условие задачи Гидроксид рубидия - соединение, которое трудно найти в химическом магазине. Представьте себе, что вы
- 3. Цель: предложить методики получения р-ра RbOH, из хлорида рубидия. Задачи: Подробно описать все происходящие процессы. Сравнить
- 4. Ограничения Сравнивать методы по дешевизне (в рублях, сложный критерий), быстроте (ед.времени) и простоте (бессмысленный критерий) мы
- 5. наш ИДЕАЛ Раствор RbOH - это жидкость, в которой есть 1. Н2О 2. ионы: Rb+ (Гидратированный)
- 6. Направления решения Смешение двух растворов. Кристаллизация из насыщенных растворов. Электролиз RbCl. Восстановление рубидия и его взаимодействие
- 7. Решение №1. «Просто добавь щёлочь» Методика Для получения 1 литра 0,1 молярного раствора RbОН: Взвешиваем 12,092
- 8. Итог Раствор содержит по 0,1 моль/л ионов: Rb+, OH-, Li+, Cl- Примеси: ионы Li+ , Cl-
- 9. Чистота против! Чистота
- 10. Выводы методу: «Просто добавь щелочь»
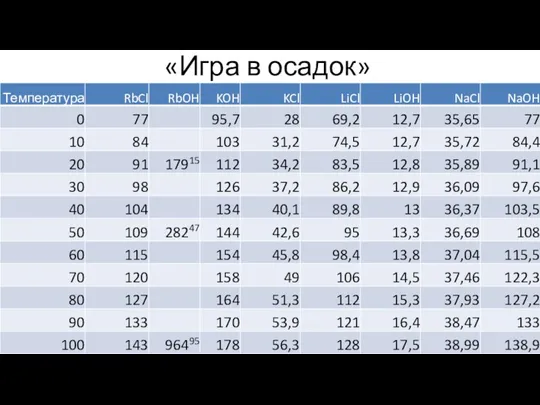
- 11. Решение №2 «Игра в осадок» Rb+(р-р) +Сl-(р-р) + Na+(р-р) + ОH-(р-р) → → Rb+(р-р) + OH-(р-р)
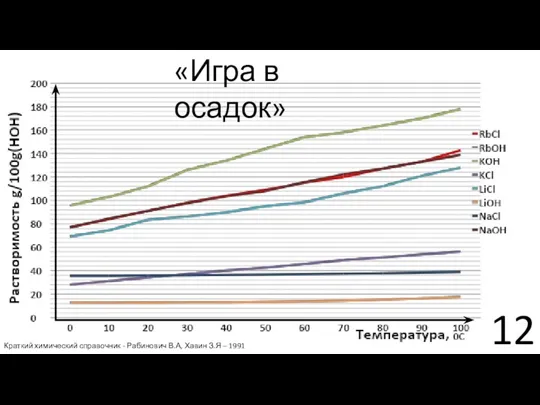
- 12. «Игра в осадок» Краткий химический справочник - Рабинович В.А, Хавин З.Я – 1991
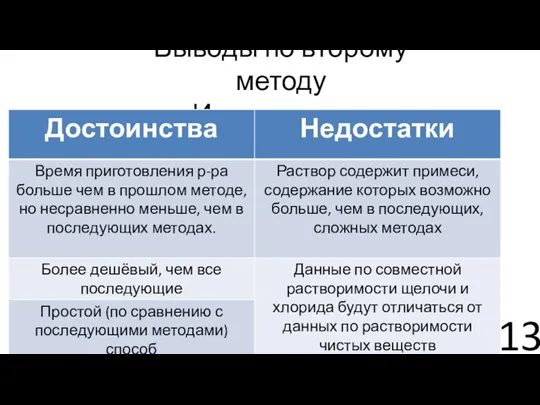
- 13. Выводы по второму методу «Игра в осадок»
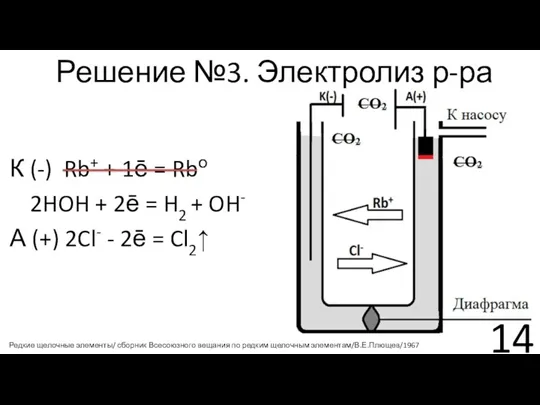
- 14. Решение №3. Электролиз р-ра К (-) Rb+ + 1ē = Rbо 2HOH + 2ē = H2
- 15. Процессы-паразиты в прианодном пространстве: Cl20 + HOH0 = ClO- + Cl- + 2H+ А(+) 2HOH -
- 16. Выводы по третьему методу
- 17. Решение №4. Восстановление 2RbCl(ж) + Ca(ж) ↔ 2Rb(г) + CaCl2(тв) + Ca(г) Ткип.(Са)= 8420С (р=1 атм.)
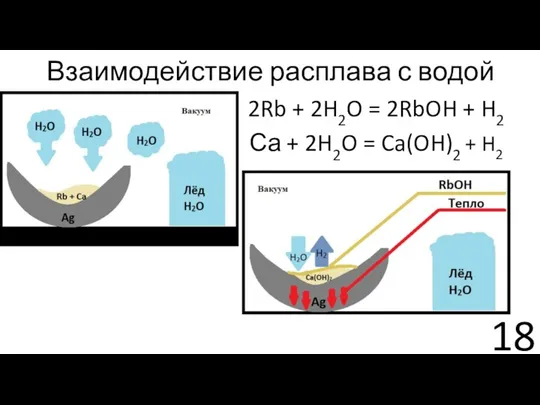
- 18. Взаимодействие расплава с водой 2Rb + 2H2O = 2RbOH + H2 Са + 2H2O = Ca(OH)2
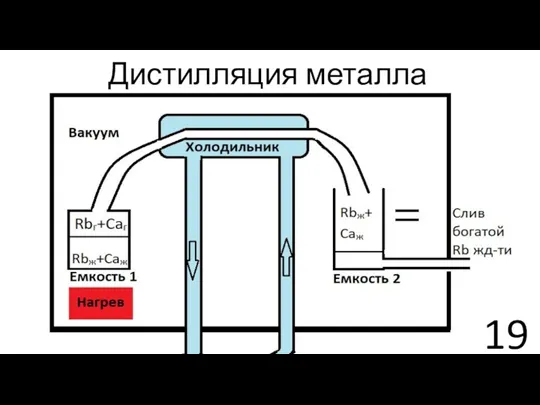
- 19. Дистилляция металла
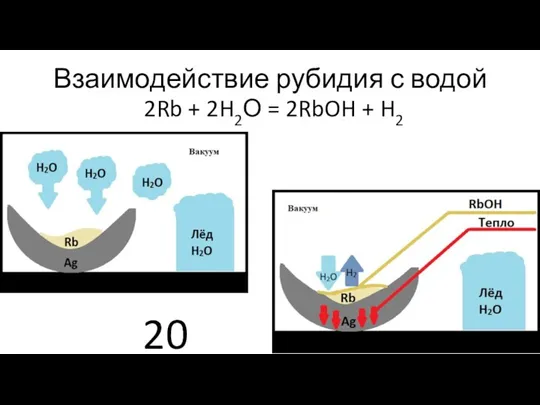
- 20. Взаимодействие рубидия с водой 2Rb + 2H2О = 2RbOH + H2
- 21. Выводы по методу
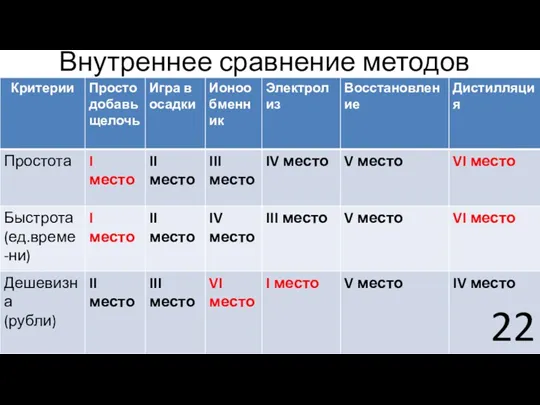
- 22. Внутреннее сравнение методов
- 23. Способы достижения нужной концентрации При помощи автотитратора: Включить прибор. Поместить электрод и наконечник титратора в анализируемый
- 24. Выводы: Предложили методы получения р-ра RbOH. Подробно описали все происходящие процессы и реакции. Сравнили методы по
- 25. Литература Редкие щелочные элементы/ сборник Всесоюзного вещания по редким щелочным элементам/В.Е.Плющев/1967 Редкие и рассеянные элементы. Химия
- 26. Спасибо за внимание!
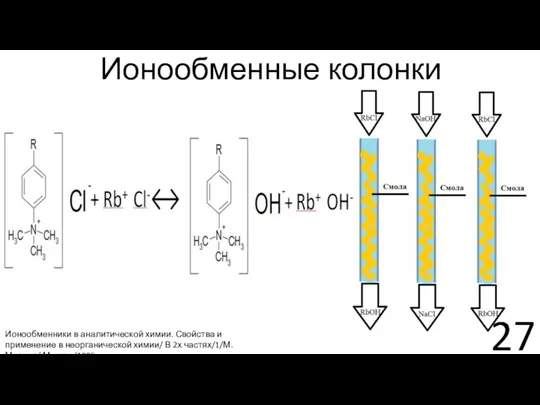
- 27. Ионообменные колонки Ионообменники в аналитической химии. Свойства и применение в неорганической химии/ В 2х частях/1/М.Мархол/ Москва/1985
- 28. Оценка «Дешевизны» Стоимость реализации метода = f ( 1. Стоимость ед. времени рабочей силы 2. Стоимость
- 29. Методика «игры в осадок» 1. Берём 100 г воды. 2. Нагреваем и термостатируем при 95 0С.
- 30. Расчёты для приготовления растворов (метод №1) Необходимая нам концентрация RbOH в р-ра – 0,1 моль/литр. Составим
- 31. «Игра в осадок»
- 32. Схема установки для электролиза
- 33. Установка для вакуумтермического восстановления
- 35. Скачать презентацию






















 Химические свойства алканов
Химические свойства алканов Особенности сжигания жидкого топлива и топливосжигающие устройства
Особенности сжигания жидкого топлива и топливосжигающие устройства Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Галогены
Галогены Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Стратегия химической промышленности
Стратегия химической промышленности Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Степень окисления
Степень окисления Липиды, биологическая роль, классификация
Липиды, биологическая роль, классификация Альдегиды и кетоны
Альдегиды и кетоны Кислород и озон
Кислород и озон Типы химических реакций. Опыты
Типы химических реакций. Опыты Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы
Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы Реакции нейтрализации
Реакции нейтрализации Камень чароит
Камень чароит Теория строения органических веществ А.М. Бутлерова
Теория строения органических веществ А.М. Бутлерова Азотсодержащие органические соединения
Азотсодержащие органические соединения Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Газовые смеси
Газовые смеси Бытовая химия в нашем доме и альтернативные способы уборки
Бытовая химия в нашем доме и альтернативные способы уборки Теория электролитической диссоциации
Теория электролитической диссоциации Алкалоиды и принципы их классификации
Алкалоиды и принципы их классификации Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Высокомолекулярные вещества полимеры
Высокомолекулярные вещества полимеры Химические свойства толуола
Химические свойства толуола Алканы. Способы получения алканов. Химические свойства алканов
Алканы. Способы получения алканов. Химические свойства алканов Химиялық элемент алюминий
Химиялық элемент алюминий