Содержание
- 2. 16.10.2020 Электролитическая диссоциация
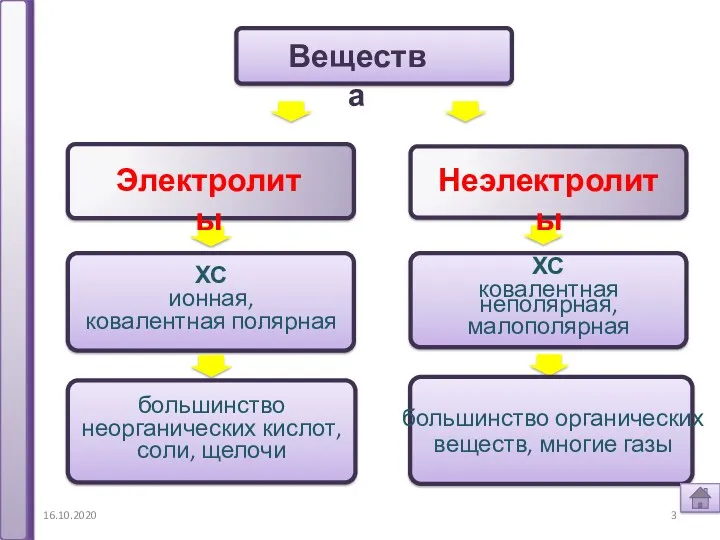
- 3. 16.10.2020 Электролиты Неэлектролиты
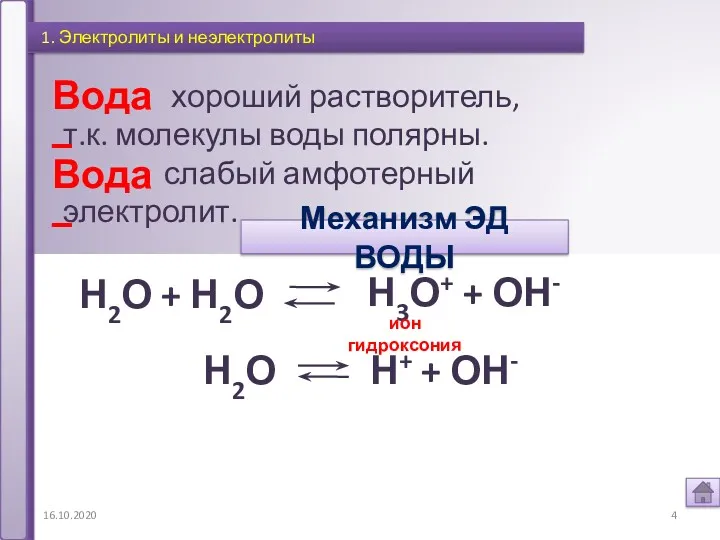
- 4. 16.10.2020 1. Электролиты и неэлектролиты Вода – хороший растворитель, т.к. молекулы воды полярны. слабый амфотерный электролит.
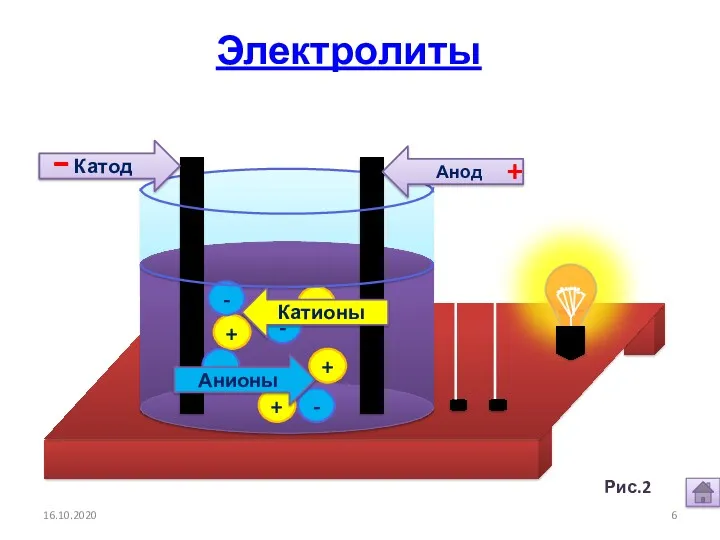
- 5. 16.10.2020 1. Электролиты и неэлектролиты это вещества, растворы и расплавы которых проводят электрический ток. Электролиты -
- 6. + + + + - - - - Анионы Катионы Анод Катод - + 16.10.2020 Электролиты
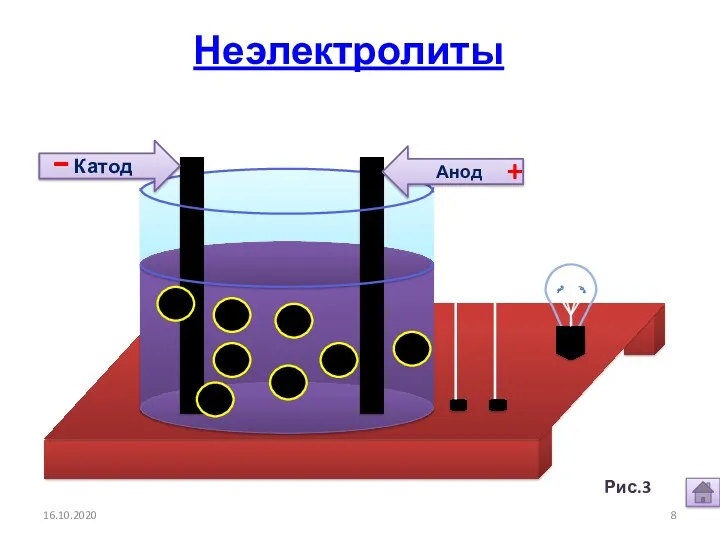
- 7. 16.10.2020 1. Электролиты и неэлектролиты это вещества, растворы или расплавы которых не проводят электрический ток. Неэлектролиты
- 8. Анод Катод - + 16.10.2020 Рис.3. Неэлектролиты
- 9. 16.10.2020 2.Электролитическая диссоциация процесс распада молекул электролита на ионы в растворе или расплаве. С.Аррениус Электролитическая диссоциация
- 10. Основные положения теории ЭД 1. Электролиты в водной среде (и в расплавленном состоянии) распадаются на положительно
- 11. Основные положения теории ЭД 2. Беспорядочное движение ионов в растворе под действием электрического поля становится направленным:
- 12. Основные положения теории ЭД 3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией)
- 13. Основные положения теории ЭД 4. Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры
- 14. 16.10.2020 отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. Степень электролитической диссоциации (α)
- 15. Основные положения теории ЭД 5. Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов.
- 16. 16.10.2020 это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только ионы
- 17. 16.10.2020 это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы.
- 18. 16.10.2020 это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного остатка.
- 20. Скачать презентацию













 Чистые вещества и смеси
Чистые вещества и смеси Химические свойства солей в свете теории электролитической диссоциации
Химические свойства солей в свете теории электролитической диссоциации Гидролиз неорганических солей
Гидролиз неорганических солей Относительная атомная масса химических элементов. Знаки химических элементов
Относительная атомная масса химических элементов. Знаки химических элементов Хімія в побуті
Хімія в побуті Химия сабағындағы өздік жұмыстар
Химия сабағындағы өздік жұмыстар Сорбционные процессы
Сорбционные процессы Химический состав клетки. Неорганические вещества клетки. Урок 1
Химический состав клетки. Неорганические вещества клетки. Урок 1 Типы кристаллических решеток, cингонии. (Лекция 2)
Типы кристаллических решеток, cингонии. (Лекция 2) Биологическая химия с основами физической и коллоидной химии
Биологическая химия с основами физической и коллоидной химии Техника безопасности на уроках химии. Решение экспериментальных задач по теме Неметаллы. Практическая работа №2
Техника безопасности на уроках химии. Решение экспериментальных задач по теме Неметаллы. Практическая работа №2 Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Спирты. Обобщающий урок
Спирты. Обобщающий урок Строение атома и атомного ядра. Изотопы
Строение атома и атомного ядра. Изотопы Мұнайдың химиялық және технологиялық жіктелуі
Мұнайдың химиялық және технологиялық жіктелуі Кислоты и щелочи. Индикаторы. 6 класс
Кислоты и щелочи. Индикаторы. 6 класс Природный газ
Природный газ Аммиак
Аммиак Химические явления. Химические реакции
Химические явления. Химические реакции Аммиак. Соли аммония
Аммиак. Соли аммония АЛКАНЫ 9 класс
АЛКАНЫ 9 класс Классификация химических реакций
Классификация химических реакций Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Неметаллические материалы
Неметаллические материалы Анализ проб воды
Анализ проб воды Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева
Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева Полимерлер-біздің болашағымыз
Полимерлер-біздің болашағымыз Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования