Содержание
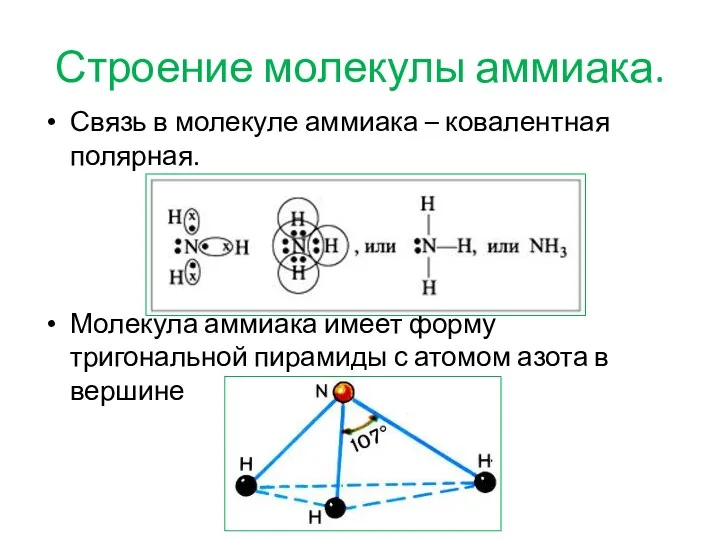
- 2. Строение молекулы аммиака. Связь в молекуле аммиака – ковалентная полярная. Молекула аммиака имеет форму тригональной пирамиды
- 3. Строение молекулы. Молекулы жидкого аммиака, как и молекулы воды, связаны между собой межмолекулярными водородными связями:
- 4. Физические свойства бесцветный газ резкий характерный запах (запах нашатырного спирта) вдвое легче воздуха хорошо растворим в
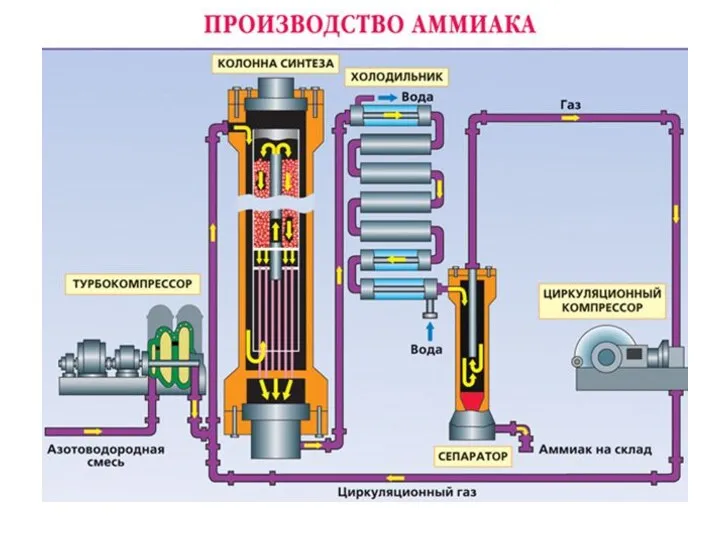
- 5. Получение 1. В промышленности - прямое взаимодействие водорода и азота: N2(г) + 3H2(г) 2NH3(г) + 45,9
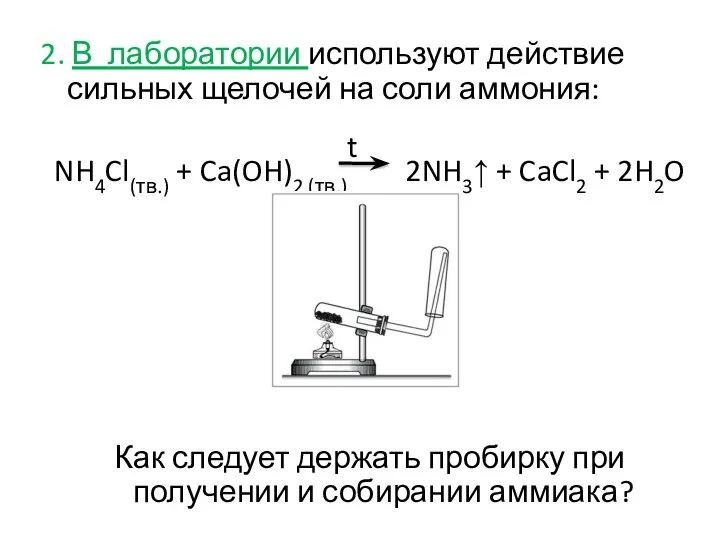
- 7. 2. В лаборатории используют действие сильных щелочей на соли аммония: NH4Cl(тв.) + Ca(OH)2 (тв.) 2NH3↑ +
- 8. Химические свойства – Реакции с изменением степени окисления атома азота (восстановительные свойства) 1. С кислородом. Горение
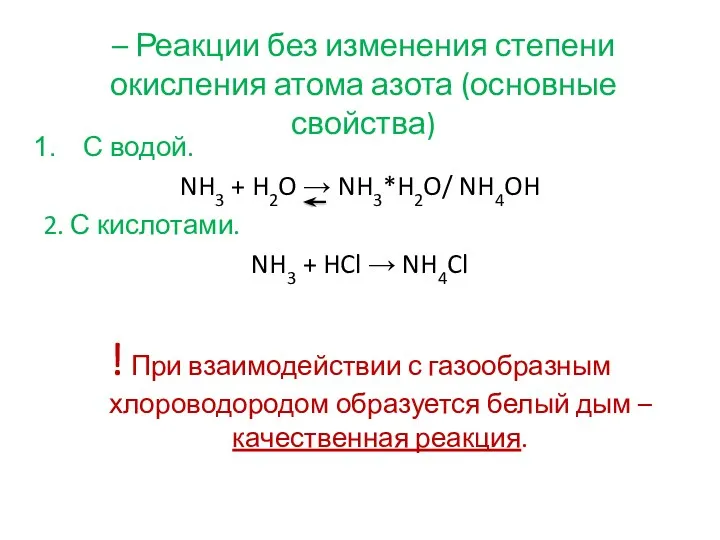
- 9. – Реакции без изменения степени окисления атома азота (основные свойства) С водой. NH3 + H2O →
- 10. Соли аммония
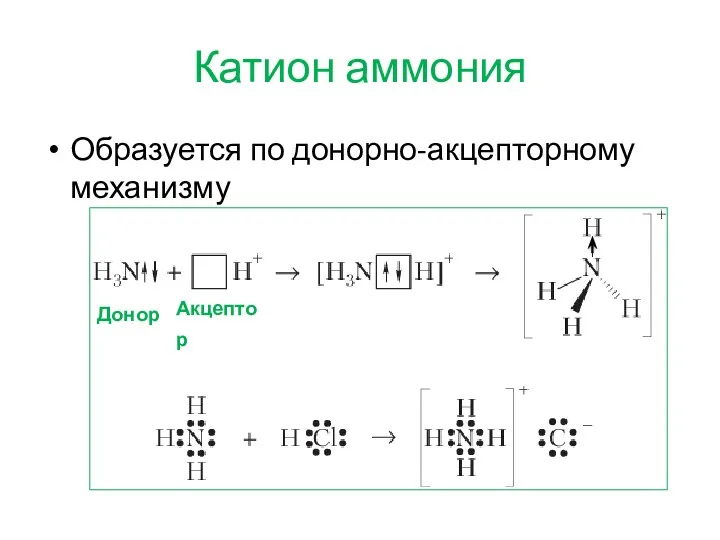
- 11. Катион аммония Образуется по донорно-акцепторному механизму Донор Акцептор
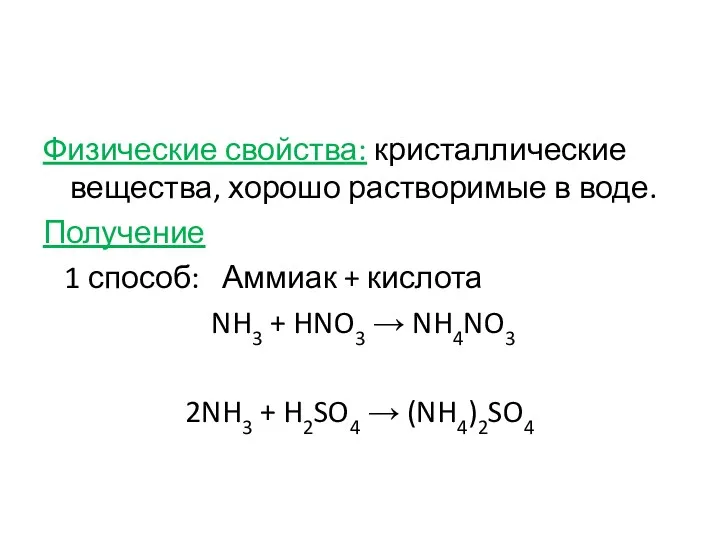
- 12. Физические свойства: кристаллические вещества, хорошо растворимые в воде. Получение 1 способ: Аммиак + кислота NH3 +
- 13. Химические свойства ОБЩИЕ С СОЛЯМИ 1. Диссоциируют в воде: NH4Cl → NH4+ + Cl- 2. С
- 15. Скачать презентацию






 Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Поверхностный мембранный потенциал. Равновесие Доннана
Поверхностный мембранный потенциал. Равновесие Доннана Основные способы получения металлов
Основные способы получения металлов Углеводороды. Предельные (насыщенные) углеводороды
Углеводороды. Предельные (насыщенные) углеводороды Набор № 3 ВС Щелочи
Набор № 3 ВС Щелочи Уравнения химических реакций
Уравнения химических реакций Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Важнейшие химические понятия и законы. Атом, химический элемент. Изотопы. Простые и сложные вещества. Основные законы химии
Важнейшие химические понятия и законы. Атом, химический элемент. Изотопы. Простые и сложные вещества. Основные законы химии Роль химии в жизни человека
Роль химии в жизни человека Алюминий и его соединения
Алюминий и его соединения Строение и свойства циклоалканов
Строение и свойства циклоалканов Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Электронные конфигурации атомов
Электронные конфигурации атомов Лекарства дома
Лекарства дома Чисті речовини та суміші. Способи розділення
Чисті речовини та суміші. Способи розділення Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Летучие яды
Летучие яды Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі
Хімічні елементи, їхні назви і символи. Поширеність хімічних елементів у природі Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач по химии (ОГЭ, ЕГЭ, Олимпиады) Получение и применение алканов
Получение и применение алканов Introduction to Biochemistry
Introduction to Biochemistry Кислые породы повышенной щелочности и щелочные
Кислые породы повышенной щелочности и щелочные Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Газовые смеси
Газовые смеси Физическая химия дисперсных систем. Лекция 7
Физическая химия дисперсных систем. Лекция 7