Содержание
- 2. Словарь Гидролиз – реакция обмена между растворимыми солями и водой Сильные кислоты – кислоты, являющиеся сильными
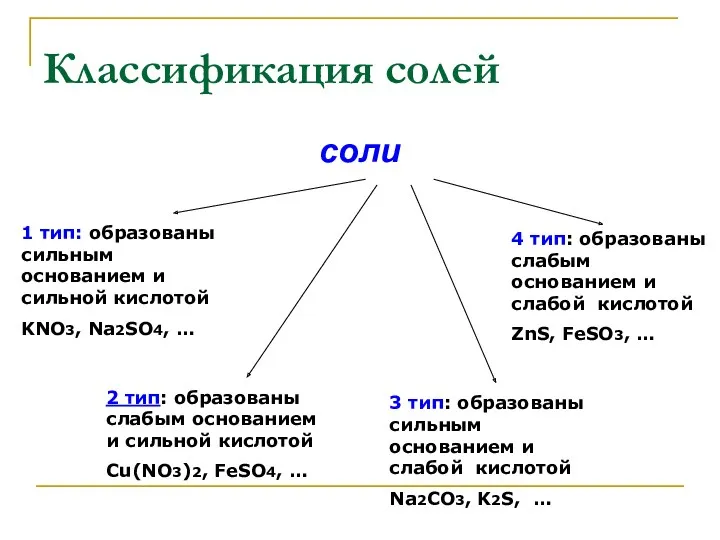
- 3. Классификация солей соли 1 тип: образованы сильным основанием и сильной кислотой KNO3, Na2SO4, … 2 тип:
- 4. Классификация солей Задание1. Разделите предложенные формулы солей на четыре типа, объясните свой выбор: BaCl2, ZnSO4, CuCl2,
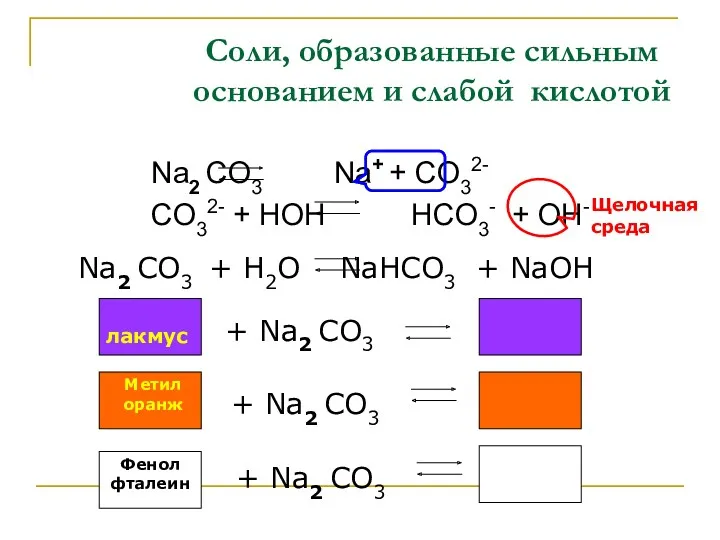
- 5. Соли, образованные сильным основанием и слабой кислотой Na2 CO3 Na+ + CO32- CO32- + HOH HCO3-
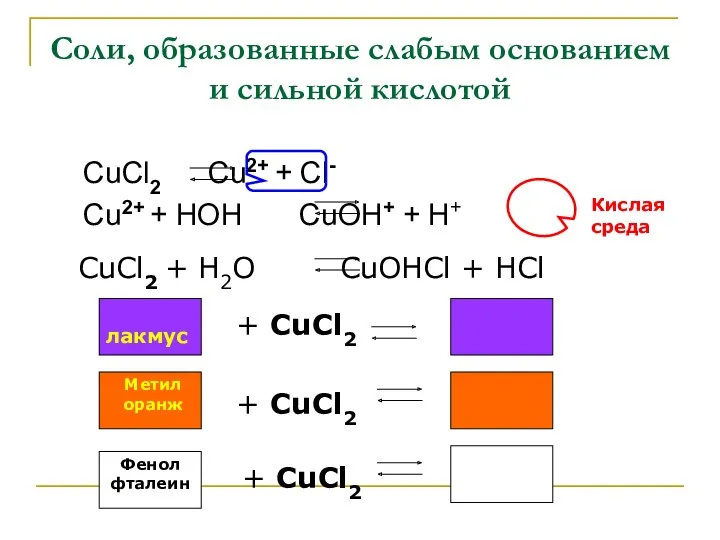
- 6. Соли, образованные слабым основанием и сильной кислотой CuCl2 Cu2+ + Cl- Cu2+ + HOH CuOH+ +
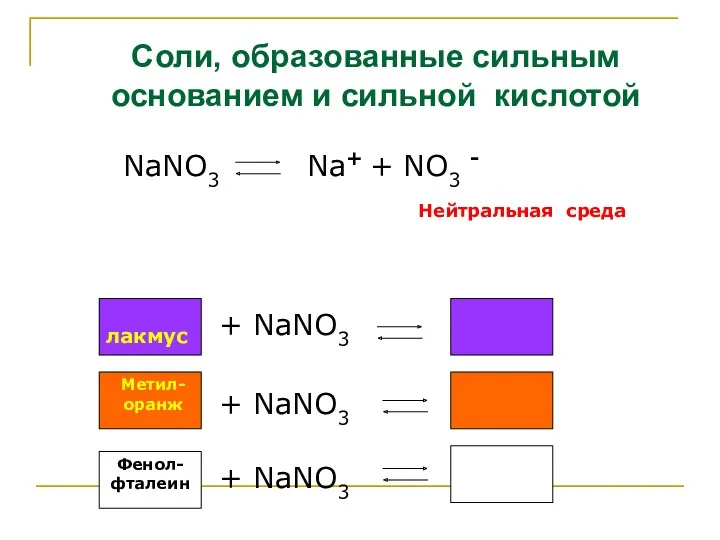
- 7. Соли, образованные сильным основанием и сильной кислотой NaNO3 Na+ + NO3 - Нейтральная среда лакмус +
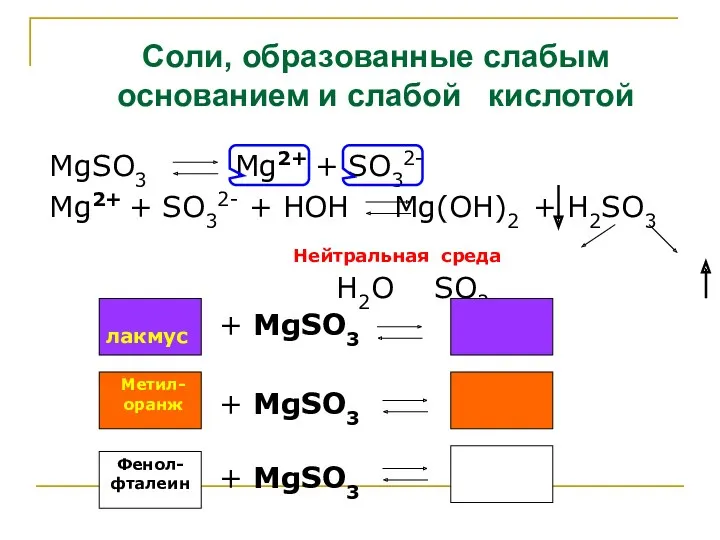
- 8. Соли, образованные слабым основанием и слабой кислотой MgSO3 Mg2+ + SO32- Mg2+ + SO32- + HOH
- 9. Проверь себя Задание 2: Определите окраску лакмуса в растворах солей: Ba(NO3)2, FeCl3, LiNO2, CoSO4, Na2SiO3, ZnS,
- 10. Проверь себя Задание 3: Исключите лишнюю соль из списка: А) ZnCl2, CuSO4, KNO3, Ni(NO3)2 Б) K2S,
- 12. Скачать презентацию




 Правила роботи на уроці
Правила роботи на уроці Взрывоопасные грузы
Взрывоопасные грузы Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Обмен нуклеотидов
Обмен нуклеотидов Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Классификация химических реакций по тепловому эффекту
Классификация химических реакций по тепловому эффекту Кислоты, их классификация и свойства. 8 класс
Кислоты, их классификация и свойства. 8 класс Химиялық жарыс кеші
Химиялық жарыс кеші Основные виды и понятия курса органической химии в старшей школе
Основные виды и понятия курса органической химии в старшей школе Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Оборотні і необоротні реакції. Хімічна рівновага
Оборотні і необоротні реакції. Хімічна рівновага Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты
Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты Органічні речовини в живій природі. Рівні структурної органшзації
Органічні речовини в живій природі. Рівні структурної органшзації Классификация химических реакций
Классификация химических реакций Характеристика строения и свойств химических элементов
Характеристика строения и свойств химических элементов Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Производство полимеров
Производство полимеров Химические свойства альдегидов
Химические свойства альдегидов Алкины. Характеристика тройной связи
Алкины. Характеристика тройной связи Биохимия
Биохимия Галогены. 9 класс
Галогены. 9 класс Производство синтетической нефти
Производство синтетической нефти Пниктогены элеметны VA группы
Пниктогены элеметны VA группы Сложные эфиры. Жиры
Сложные эфиры. Жиры Побочная подгруппа 1 и 2. Медь
Побочная подгруппа 1 и 2. Медь Способы выражения состава растворов
Способы выражения состава растворов Кислородсодержащие соединения. Тема 1: спирты
Кислородсодержащие соединения. Тема 1: спирты Амины. Номенклатура аминов
Амины. Номенклатура аминов