Содержание
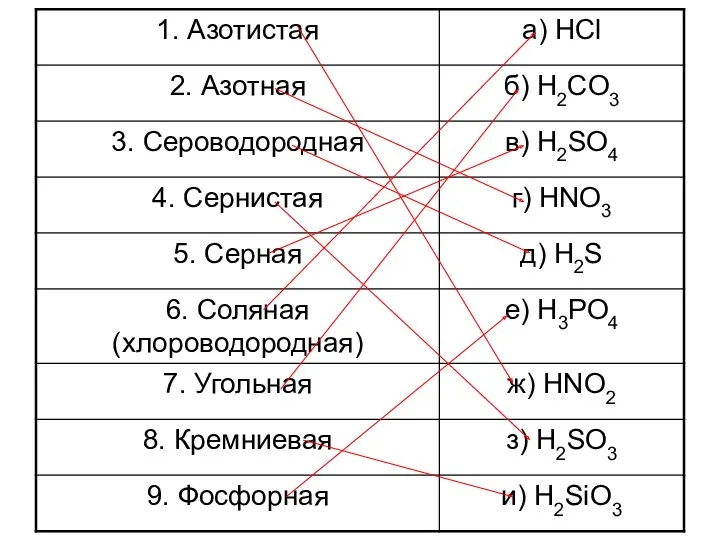
- 2. H2SO4 Таблица 10 стр.210
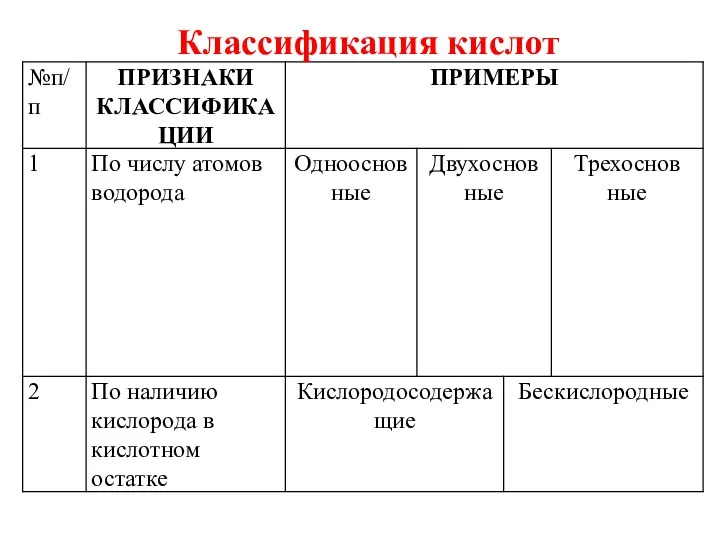
- 5. Классификация кислот
- 6. Кислоты, их классификация и свойства 8 класс
- 7. Кислоты – это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются ионы водорода,
- 8. Классификация кислот по признаку растворимости Угольная и сернистая кислоты в свободном виде не существуют, так как
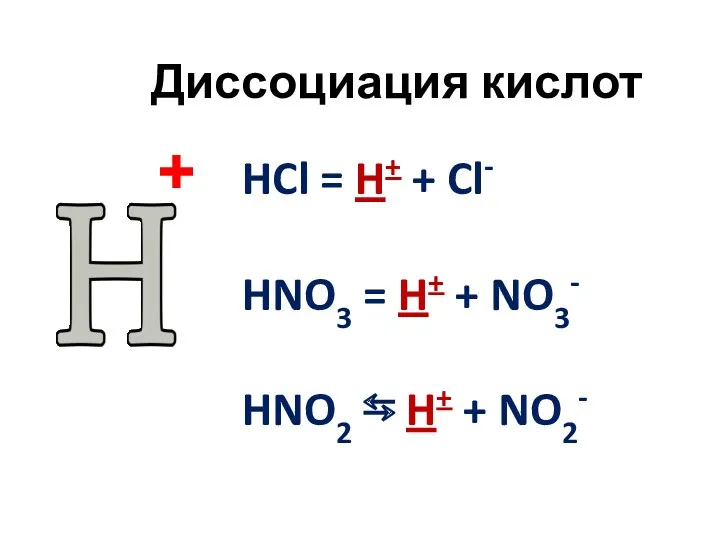
- 9. Диссоциация кислот HCl = H+ + Cl- HNO3 = H+ + NO3- HNO2 ⇆ H+ +
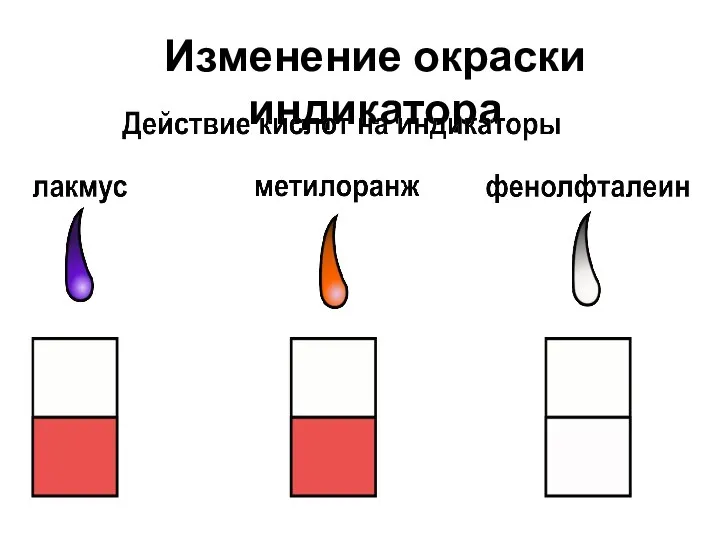
- 10. Изменение окраски индикатора
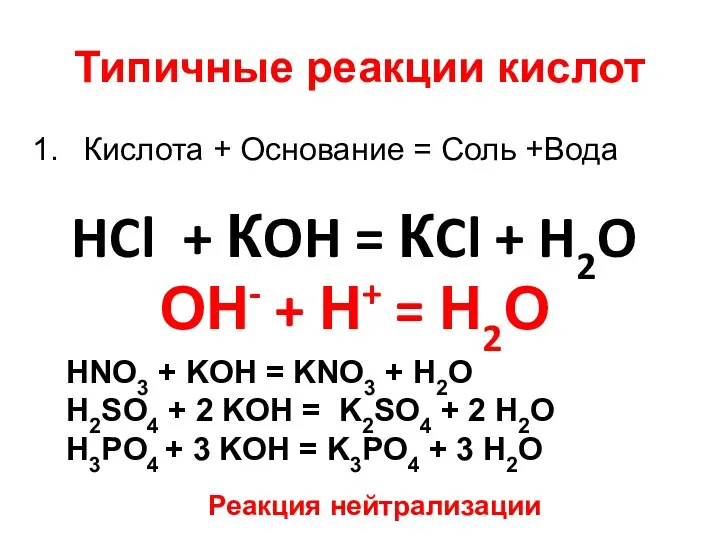
- 11. Типичные реакции кислот Кислота + Основание = Соль +Вода Кислота + Оксид металла = Соль +
- 12. Типичные реакции кислот Кислота + Основание = Соль +Вода HCl + КOH = КCl + H2O
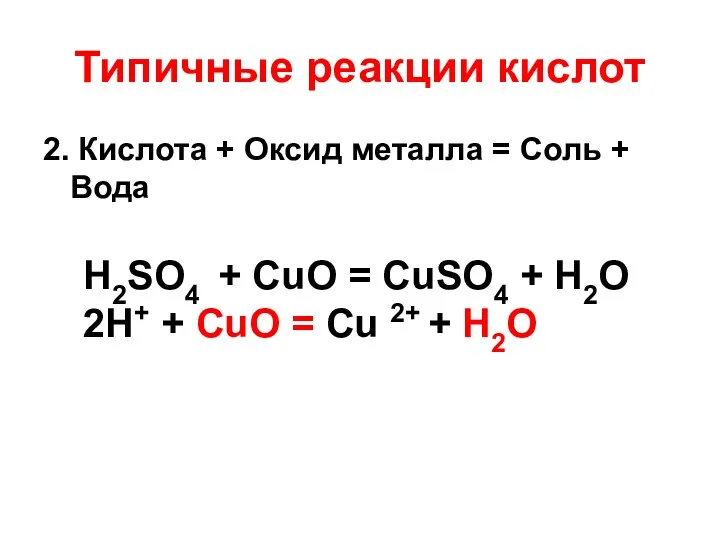
- 13. Типичные реакции кислот 2. Кислота + Оксид металла = Соль + Вода H2SO4 + CuO =
- 14. Типичные реакции кислот 3. Кислота + Металл = Соль + Водород 2HCl + Zn = ZnCl2
- 15. Вытеснительный ряд металлов Русский химик Н. Н. Бекетов исследовал металлы и расположил их в вытеснительный ряд
- 16. Для этих реакций необходимы условия: Металл должен находиться в ряду напряжений до водорода; Должна получиться растворимая
- 17. Типичные реакции кислот 4.Кислота + Соль = Новая кислота + Новая соль HCl + AgNO3 =
- 18. Запомните: Кислоты изменяют окраску индикаторов; Кислоты реагируют с основаниями; Кислоты реагируют с оксидами металлов; Кислоты при
- 19. Задание №1 1. Закончите схемы возможных реакций. Укажите их тип. а) H2SO4 + NaOH → …
- 20. Ответ а) H2SO4 + 2NaOH = Na2SO4 + 2H2O(реакция обмена) б) 2NaCl + H2SO4= Na2SO4 +
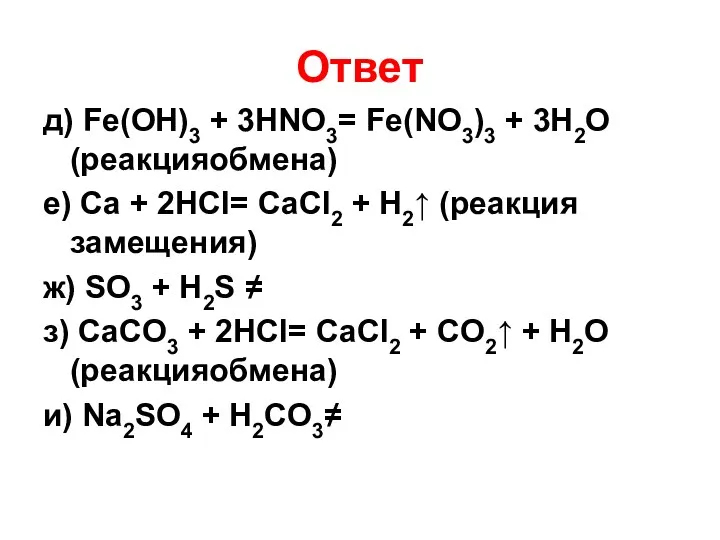
- 21. Ответ д) Fe(OH)3 + 3HNO3= Fe(NO3)3 + 3H2O (реакцияобмена) е) Ca + 2HCl= CaCl2 + H2↑
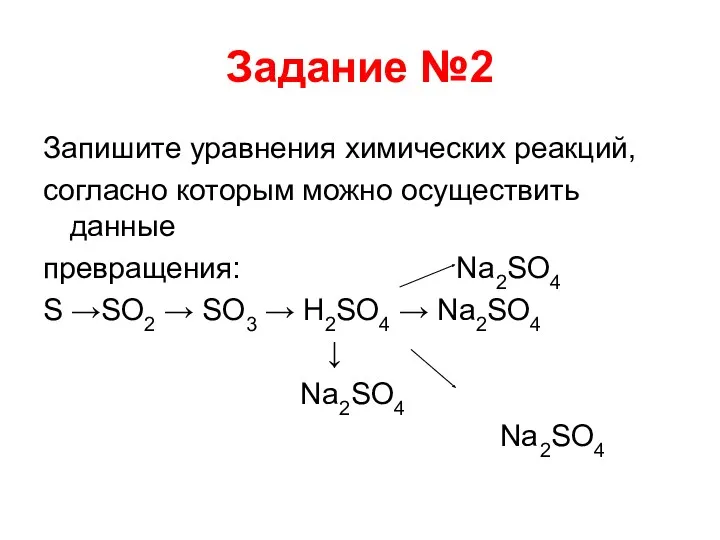
- 22. Задание №2 Запишите уравнения химических реакций, согласно которым можно осуществить данные превращения: Na2SO4 S →SO2 →
- 23. Ответ: 1) S + O2 = SO2 2) 2SO2 + O2 = 2SO3 3) SO3 +
- 24. Продолжите фразу Я научился… Я узнал… Мне было интересно… Мне было трудно…
- 27. Скачать презентацию















 Генетическая связь между классами веществ
Генетическая связь между классами веществ Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Химический эквивалент. Формульные единицы
Химический эквивалент. Формульные единицы Свойства алкадиенов и их получение
Свойства алкадиенов и их получение Ионные уравнения реакций
Ионные уравнения реакций Элементы VII группы периодической таблицы Д.И. Менделеева
Элементы VII группы периодической таблицы Д.И. Менделеева Свойства фосфора
Свойства фосфора Азотсодержащие органические соединения
Азотсодержащие органические соединения Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi
Ерiтiндiлер туралы iлiм. Сұйытылған бейэлектролит және электролит ерiтiнндiлерiнiң коллигативтiк қасиеттерi Месторождения нефрита
Месторождения нефрита Значение органической химии в жизни человека
Значение органической химии в жизни человека Получение и распознавание водорода
Получение и распознавание водорода Метаморфогенные месторождения
Метаморфогенные месторождения Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Геохимия ландшафтов
Геохимия ландшафтов ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ
ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ Цветные металлы и сплавы
Цветные металлы и сплавы Серебро. История
Серебро. История Оксиды (1 этап изучения). 8 класс
Оксиды (1 этап изучения). 8 класс Базовое нефтехимическое сырье
Базовое нефтехимическое сырье Күйдіргіш натрий
Күйдіргіш натрий Никель – тяжелый металл
Никель – тяжелый металл Prezentatsia
Prezentatsia Серная кислота H2SO4
Серная кислота H2SO4 Застосування неметалів
Застосування неметалів Кислород
Кислород Периодическая система химических элементов Д.И.Менделеева
Периодическая система химических элементов Д.И.Менделеева