Содержание
- 2. Общая характеристика элементов Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные
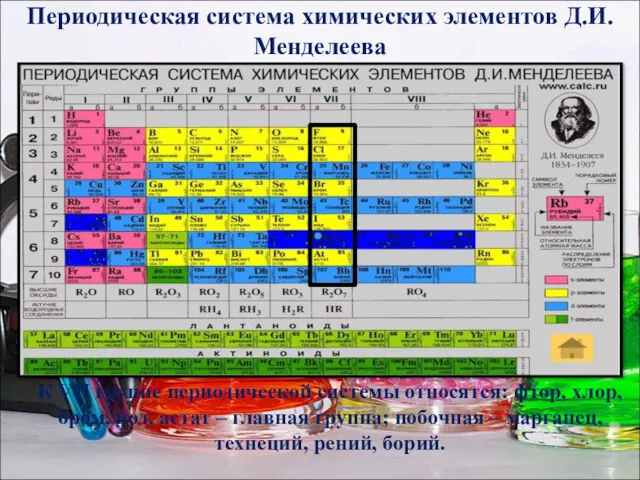
- 3. Периодическая система химических элементов Д.И.Менделеева К VII группе периодической системы относятся: фтор, хлор, бром, иод, астат
- 4. Фтор История открытия галогенов Хлор Бром Йод Астат Марганец
- 5. В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C, смог
- 6. В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал
- 7. В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал
- 8. В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого
- 9. В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат
- 10. Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и
- 11. Физические свойства Фтор Фтор бледножелтый высокореакционноспособный газ, вызывающий раздражение дыхательных путей и коррозию материалов. .
- 12. Хлор Хлор едкий, химически агрессивный газ темного зеленовато-желтого цвета, менее реакционноспособен по сравнению со фтором.
- 13. Бром Бром - тяжелая красно-коричневая жидкость при обычных условиях, но легко испаряется, превращаясь в едкий газ.
- 14. Иод Иод - темнофиолетовое, с металлическим оттенком, вещество, твердое , но легко сублимирующееся. Часто встречается в
- 15. Астат Астат радиоактивный элемент, единственный галоген, не имеющий стабильного изотопа. Он существует только в следовых количествах
- 16. Марганец Твёрдый, хрупкий металл серебристо-белого цвета. Наряду с железом и его сплавами относится к чёрным металлам.
- 17. Cl2 - свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он
- 18. Br2 - химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика
- 19. Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F
- 20. Применение элементов VII группы
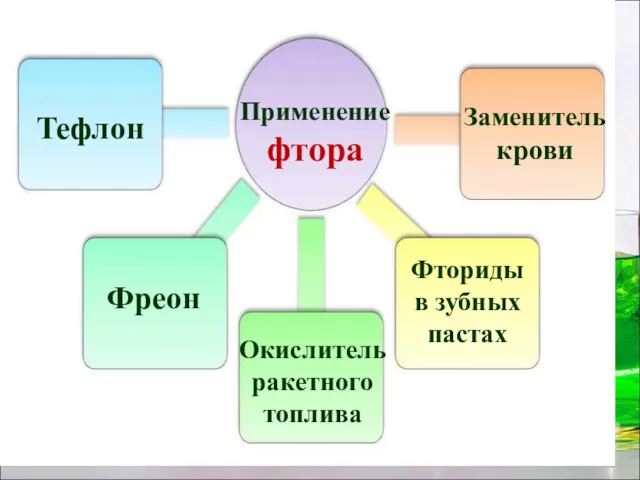
- 21. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах
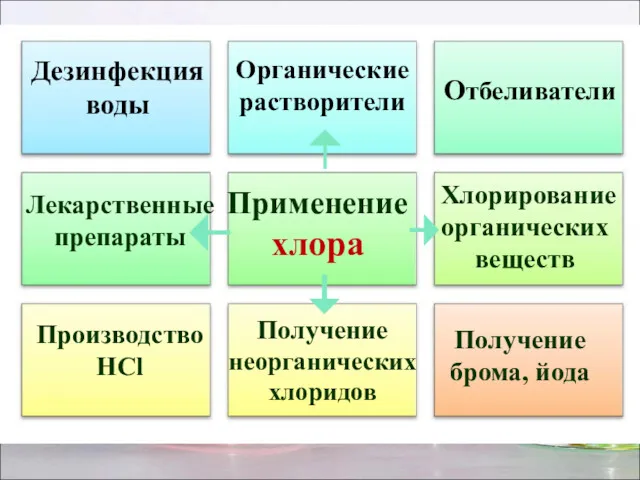
- 22. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических
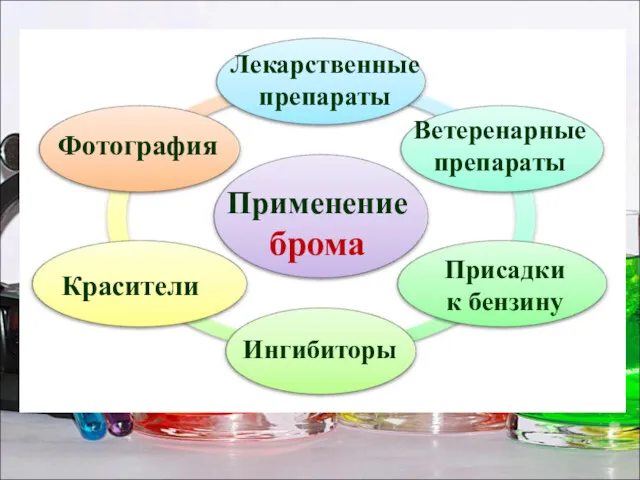
- 23. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину
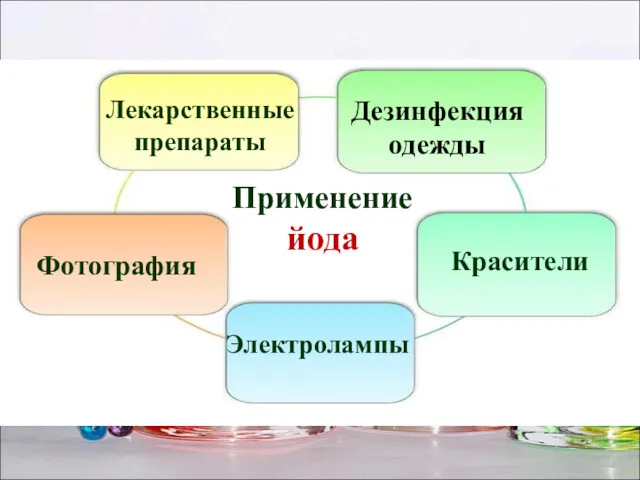
- 24. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы
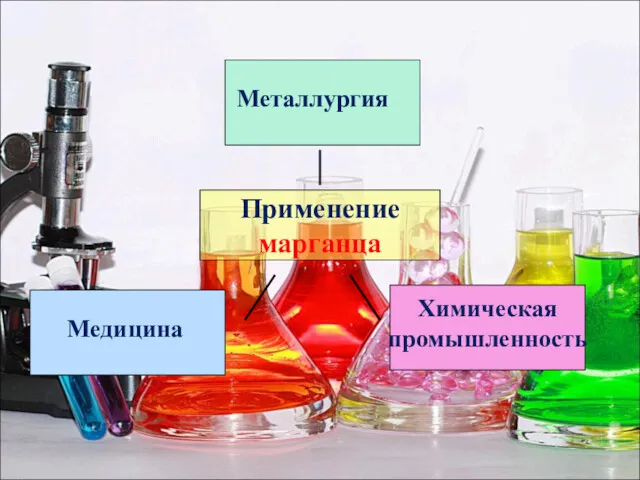
- 25. Применение марганца Металлургия Химическая промышленность Медицина
- 26. «Химия-9», О.С.Габриелян, М, Дрофа,2005г, стр 78-90 «Химия в действии», М.Фримантл, М, «Мир»,1991г, стр 269-286. «Неорганическая химия
- 28. Скачать презентацию



















 Бытовая химия. Правила безопасного обращения со средствами бытовой химии
Бытовая химия. Правила безопасного обращения со средствами бытовой химии Висбрекинг (перспективный процесс ТК)
Висбрекинг (перспективный процесс ТК) Камни и Лев
Камни и Лев Алканы (предельные углеводороды)
Алканы (предельные углеводороды) Кристаллическое состояние вещества в природе
Кристаллическое состояние вещества в природе Серная кислота. Свойства разбавленной серной кислоты, соли серной кислоты
Серная кислота. Свойства разбавленной серной кислоты, соли серной кислоты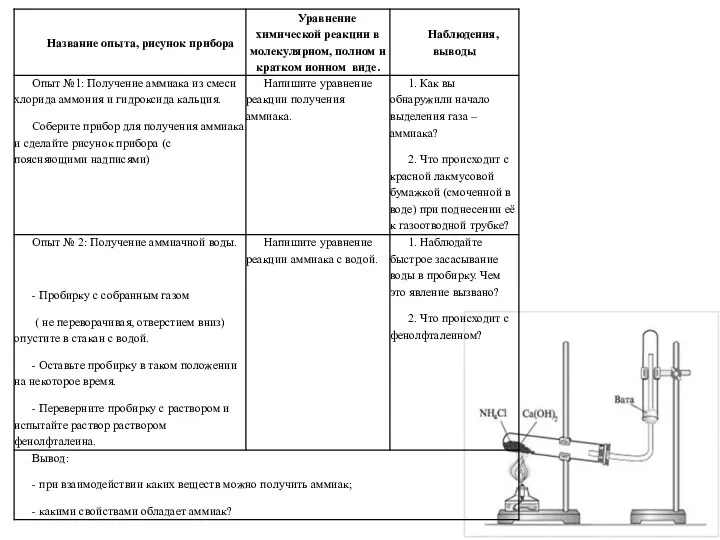 Получение аммиака и изучение его свойств
Получение аммиака и изучение его свойств Электролит және бейэлектролит ерітінділердің коллигативті қасие
Электролит және бейэлектролит ерітінділердің коллигативті қасие Химический турнир
Химический турнир Окислительно-восстановительные реакции. Основные положения электронной теории ОВР
Окислительно-восстановительные реакции. Основные положения электронной теории ОВР Фосфор и его соединения
Фосфор и его соединения Неорганические полимеры
Неорганические полимеры Спирты. Определение. Классификация
Спирты. Определение. Классификация Синтетический каучук и его применение
Синтетический каучук и его применение Вещества. Чистые вещества. Смеси
Вещества. Чистые вещества. Смеси Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Вычисление массовой доли растворенного вещества. 8 класс
Вычисление массовой доли растворенного вещества. 8 класс Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Электролиз
Электролиз Изучение свойств тиосульфата натрия
Изучение свойств тиосульфата натрия Кислород и озон
Кислород и озон Цветные маталлы и сплавы
Цветные маталлы и сплавы Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Распространенность химических элементов на земле и в космосе
Распространенность химических элементов на земле и в космосе Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г
Актуальные вопросы содержания контрольных измерительных материалов ЕГЭ в 2019 г Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях