Содержание
- 2. Цель урока: 1. Рассмотрение свойств разбавленной серной кислоты с точки зрения электролитической диссоциации. 2. Продолжить формирование
- 3. Ход урока: Повторение предыдущей темы: 1. Что такое кислота. 2. Формула серной кислоты, валентность атома серы.
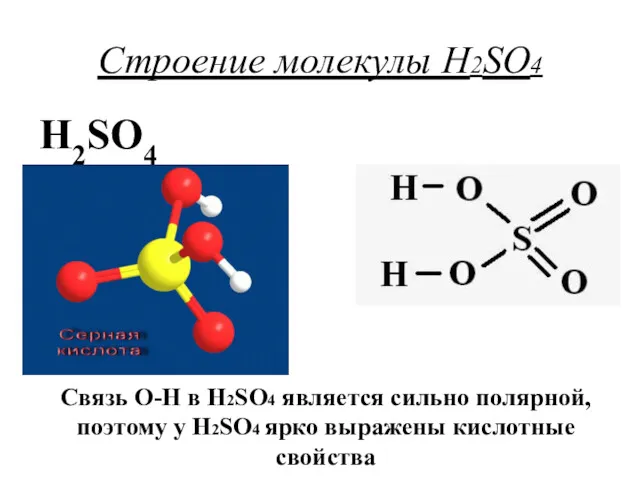
- 4. Строение молекулы H2SO4 H2SO4 Связь О-Н в H2SO4 является сильно полярной, поэтому у H2SO4 ярко выражены
- 5. Физические свойства Тяжелая маслянистая жидкость ("купоросное масло"); p = 1,84 г/см3; Нелетучая, хорошо растворима в воде
- 6. Разбавленная серная кислота проявляет все характерные свойства кислот: 1. Изменяет цвет индикаторов. 2. Взаимодействует с металлами,
- 7. Лабораторная работа (инструкция). Изучение свойств серной кислоты и её солей. Налейте в пробирку 2 мл раствора
- 8. 1. Разбавленная серная кислота сильный электролит, окислителем является катион водорода H+. Она изменяет цвет индикаторов :
- 9. 2.Взаимодействие с металлами, стоящими в ряду напряжений до водорода( с выделением водорода). Реакция замещения. Металл +
- 10. 3. Взаимодействие с оксидами ( основными и амфотерными), реакция обмена. Оксид металла + кислота= соль (сульфат
- 11. 4. Взаимодействие с основаниями: 1. С щелочами, реакция нейтрализации. Щёлочь + кислота = сульфат + вода
- 12. 5. Взаимодействие с солями слабых (летучих) кислот, реакция обмена. Кислота + соль = сульфат + летучая
- 13. 6. Качественная реакция на серную кислоту и её соли на ( сульфат анион SO4(2-)) реактивом является
- 14. Вывод: 1. Проявляет разбавленная серная кислота свойства, характерные свойствам кислот? 2. Какая из кислот ( концентрированная
- 16. Скачать презентацию












 Автомобильные бензины
Автомобильные бензины Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Basic concepts and laws of chemical thermodynamics
Basic concepts and laws of chemical thermodynamics Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Щелочные металлы
Щелочные металлы Химические свойства серной кислоты
Химические свойства серной кислоты Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов
Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов Природный каучук
Природный каучук История открытия химических веществ
История открытия химических веществ Реакция Бэйлиса Хиллмана-Мориты
Реакция Бэйлиса Хиллмана-Мориты Метод окислительно-восстановительного титрования (лекция 7)
Метод окислительно-восстановительного титрования (лекция 7) Вищі карбонові кислоти. Мила. Синтетичні миючі засоби
Вищі карбонові кислоти. Мила. Синтетичні миючі засоби Аурум
Аурум Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Алкены
Алкены Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер
Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер Природный газ и его свойства. Раздел 1
Природный газ и его свойства. Раздел 1 Сероводород. Сульфиды
Сероводород. Сульфиды Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Получение и приминение этилена
Получение и приминение этилена Экспертные системы распознавания химических веществ. Тест
Экспертные системы распознавания химических веществ. Тест Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Сероводород. Сульфиды
Сероводород. Сульфиды Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Разнообразие неметаллов
Разнообразие неметаллов Химическая термодинамика. Кинетика химических реакций. Химическое равновесие
Химическая термодинамика. Кинетика химических реакций. Химическое равновесие