Содержание
- 2. Роль заданий с развернутым ответом в КИМ ЕГЭ по химии
- 3. Особенности заданий для стандартизированной оценки учебных достижений учащихся Строгое соответствие содержания заданий нормативной базе ГИА (ФК
- 4. Подходы к отбору содержания заданий части 2 значимость проверяемого материала для общеобразовательной подготовки выпускников средней школы;
- 5. Роль заданий части 2 в КИМ ЕГЭ по химии В системе КИМ ЕГЭ заданиям с РО
- 6. Особенности заданий с РО Выполнение заданий с развернутым ответом требует от выпускника: прочных системных теоретических знаний
- 7. Документы, регламентирующие содержание и структуру КИМ ЕГЭ по химии Спецификация контрольных измерительных материалов для проведения в
- 8. «Спецификация контрольных измерительных материалов для проведения в 2019 году ЕГЭ по химии» Содержит информацию о назначении
- 9. Обобщённый план экзаменационной работы Для каждой позиции в плане указаны: проверяемые элементы содержания и их коды
- 10. Кодификатор Содержание КИМ ЕГЭ определяется на основе ФК ГОС среднего (полного) общего образования по химии, базовый
- 11. Демонстрационный вариант на его примере можно получить представление о том, сколько заданий в экзаменационном варианте, какие
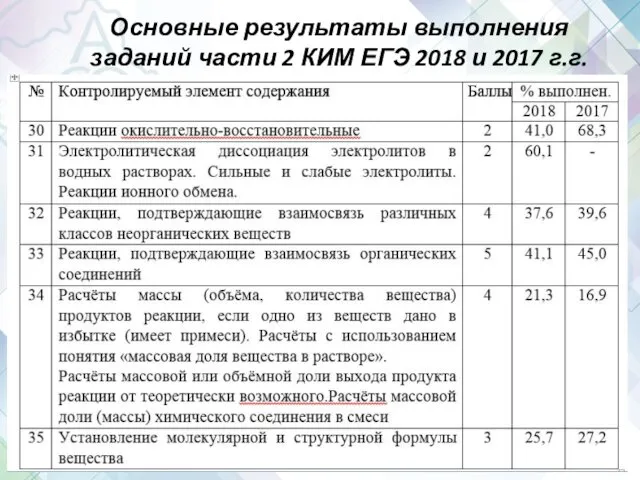
- 12. Основные результаты выполнения заданий части 2 КИМ ЕГЭ 2018 и 2017 г.г.
- 13. Изменения в части 2 КИМ ЕГЭ В 2018 году в часть 2 были включены задания 30
- 14. Работа экспертов ПК при проверке ответов выпускников 1. При проверке заданий с развёрнутым ответом эксперт руководствуется
- 15. Работы экспертов ПК 2. Проверка и оценивание выполнения заданий с развернутым ответом осуществляется на основе поэлементного
- 16. Задание 30 В 2017 г задание 30 (ОВР) оценивалось максимально в 3 балла, однако в 2018
- 17. Задания 30 и 31 Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция.
- 18. Оценивание задания 30
- 19. Оценивание задания 30 Возможные варианты ответа: 3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 +
- 20. Задание 30 Элемент 1. Записано уравнение реакции (1 балл): выбраны окислитель и восстановитель; записаны продукты с
- 21. В «Памятке эксперта» даны дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций: в качестве исходных
- 22. Задание 30 Элемент 2. Составлен электронный баланс, указаны окислитель и восстановитель – 1 балл Ставится 1
- 23. Такие обозначения степеней окисления как N5+ и N4+ (сначала цифра, затем знак) считаются неверными. Исключение: у
- 24. Запись электронного баланса K2Cr2O7 + KBr + H2SO4 → Cr2(SO4)3 + Br2 + … 2Cr+6 +
- 25. В качестве окислителя и восстановителя допустимо указывать как элементы в соответствующей строчке электронного баланса, так и
- 26. Дополнительные рекомендации, которые необходимо учитывать в случае проблемных ситуаций. степень окисления 0 может не указываться экзаменуемым;
- 27. Задание 30 Примечание 1: Если допущены грубые ошибки в составлении уравнения, нарушена логика ОВР или использованы
- 28. Задание 30 Важнейшие окислители: O2, Cl2, Br2, HNO3, H2SO4(конц.), KMnO4, MnO2, K2Cr2O7, K2CrO4, KClO, KClO3, H2O2,
- 29. Задание 30 Примеры реакций с участием HNO3: * Допускается запись NO в качестве продукта восстановления HNO3,
- 30. Задание 30 Примеры реакций с участием H2SO4 (конц.): При использовании сильных восстановителей (активных металлов, бромидов, иодидов)
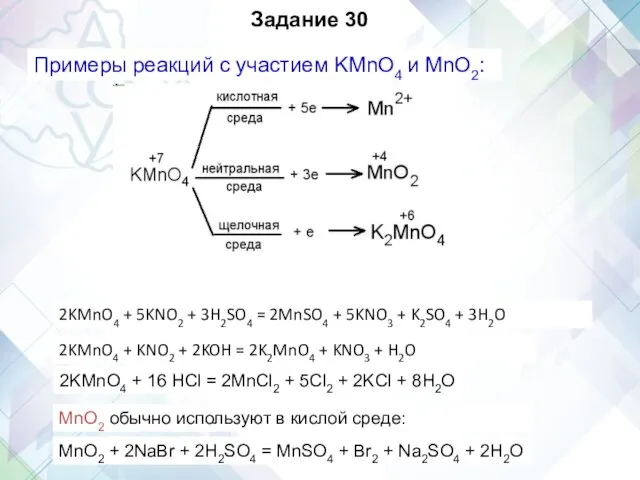
- 31. Задание 30 Примеры реакций с участием KMnO4 и MnO2: 2KMnO4 + 16 HCl = 2MnCl2 +
- 32. Задание 30 Хроматы и дихроматы чаще используют в кислой среде, восстановление протекает до соединений Cr(III): При
- 33. Задание 30 О важнейших восстановителях и продуктах их окисления: Cложные вещества, содержащие атом в низшей степени
- 34. Задание 30 Сложные вещества, содержащие катионы металлов, заряд которых может возрасти, например, Fe2+, соединения меди(I), соединения
- 35. Пример 5 Перечень веществ: иодид калия, серная кислота, гидроксид алюминия, оксид марганца(IV), нитрат магния Задание 30
- 36. Пример 6 Перечень веществ: иодид калия, серная кислота, гидроксид алюминия, оксид марганца(IV), нитрат магния Задание 30
- 37. Неверно составлено уравнение реакции, однако логика ОВР не нарушена. Электронный баланс составлен верно, окислитель и восстановитель
- 38. Допущена грубая ошибка в составлении уравнения, нарушена логика ОВР второй элемент ответа (электронный баланс) не рассматривается
- 39. Задание 31
- 40. Задание 31 Ионные уравнения реакций отражают суть тех изменений, которые происходят при взаимодействии веществ − электролитов
- 41. Задание 31 Реакции образования гидроксокомплексов при взаимодействии растворов щелочей и растворимых солей цинка и алюминия также
- 42. Задание 31 Некоторые особые случаи Кислые соли диссоциируют ступенчато, например: NaHSO3 → Na+ + HSO3− (первая
- 43. Задание 31 Оценка: 1 балл Пример 11
- 44. Задание 31 Оценка: 1 балл Пример 13 В сокращенном ионном уравнении удвоенные коэффициенты не допускаются!
- 45. Задание 32 Генетическая взаимосвязь неорганических веществ
- 46. Элементы содержания, проверяемые заданием (см. кодификатор):
- 47. Необходимо проявить умение составлять уравнения реакций, соответсвующих всем типам взаимодействия неорганических веществ: кислотно-основное взаимодействие; реакции ионного
- 48. Каждый из четырёх элементов ответа считать верным если: правильно записаны все формулы веществ − участников реакции;
- 49. Задание 32 При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при
- 50. Верно написаны 2, 3 и 4 уравнения реакций. Оценка: 3 балла Задание 32
- 51. Уравнение 1- пропущен коэффициент перед формулой нитрата меди; Уравнение 2 – неверный коэффициент перед формулой диоксида
- 52. генетическая связь органических веществ характерные химические свойства органических веществ различных классов Проверяемые ведущие элементы содержания Задание
- 53. Критерии оценивания выполнения задания 33
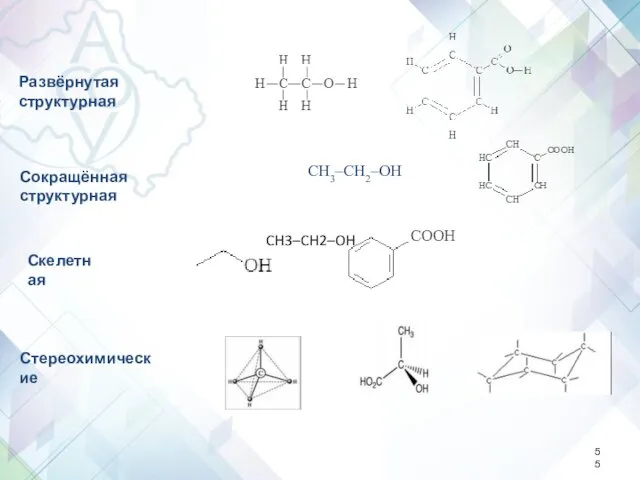
- 54. В ответе экзаменуемого допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи
- 55. Развёрнутая структурная Сокращённая структурная CH3–CH2–OH CH3–CH2–OH Скелетная Стереохимические
- 56. CH3–C6H4–COOH или C6H4(NO2)OH, C6H5C2H4Cl - использование таких формул недопустимо Допустимо Допустимо использование молекулярных формул для простейших
- 57. При записи уравнения химической реакции экзаменуемый может: не использовать обозначения осадка «↓» или газа «↑»; не
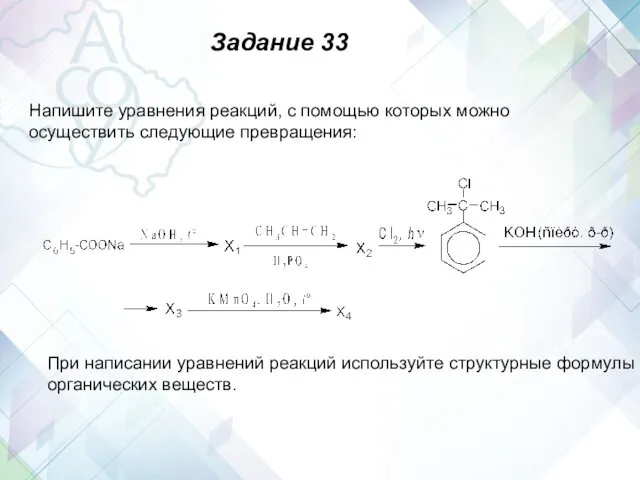
- 58. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: При написании уравнений реакций используйте структурные
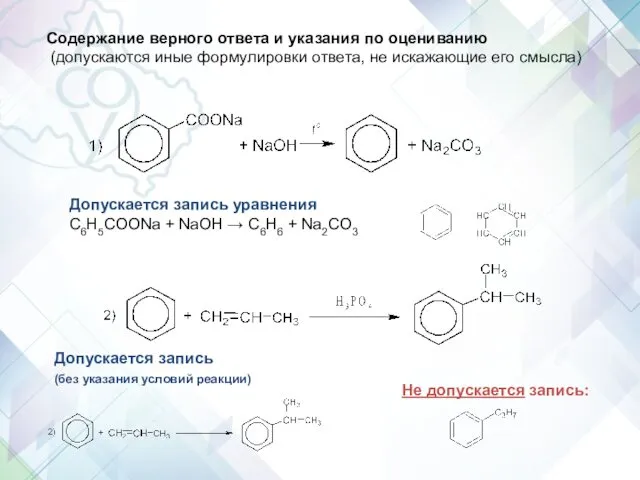
- 59. Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) Допускается
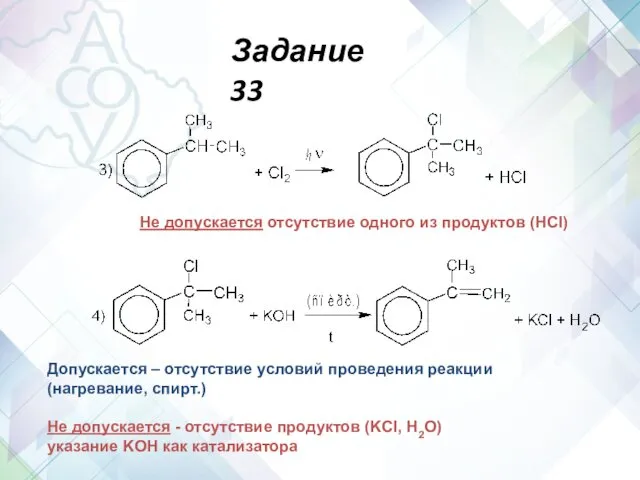
- 60. Не допускается отсутствие одного из продуктов (HCl) Допускается – отсутствие условий проведения реакции (нагревание, спирт.) Не
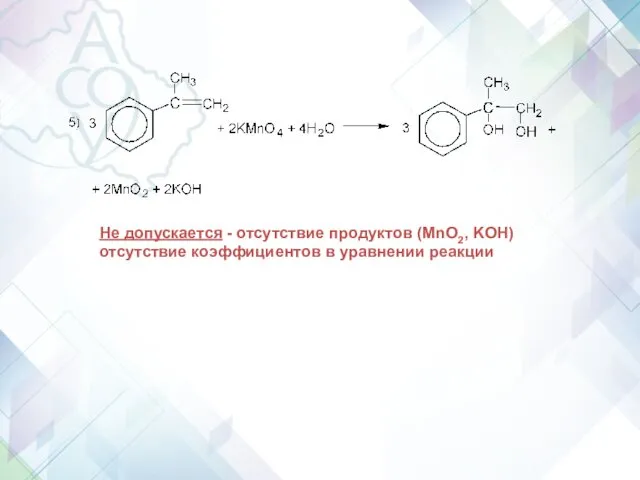
- 61. Не допускается - отсутствие продуктов (MnO2, KOH) отсутствие коэффициентов в уравнении реакции
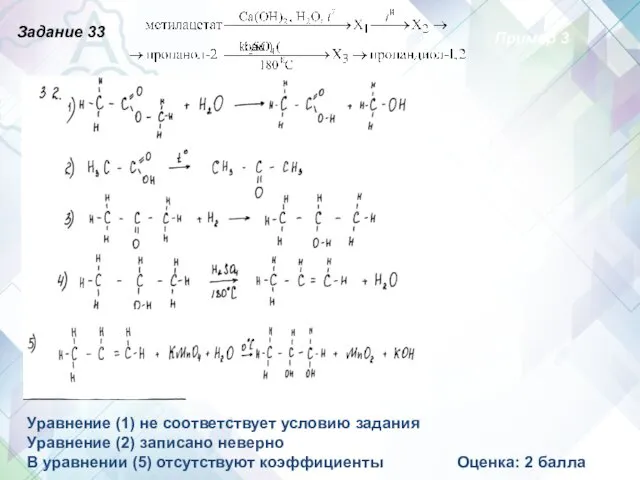
- 62. Уравнение (1) не соответствует условию задания Уравнение (2) записано неверно В уравнении (5) отсутствуют коэффициенты Пример
- 63. Пример 10 Оценка: 4 балла Задание 33 X1 бромэтан X2 ацетальдегид Х2 бутадиен-1,3 Уравнение
- 64. Оценка: 2 балла: (1) уравнение – 0 баллов, (2) и (3) уравнения– по 1баллу (4) и
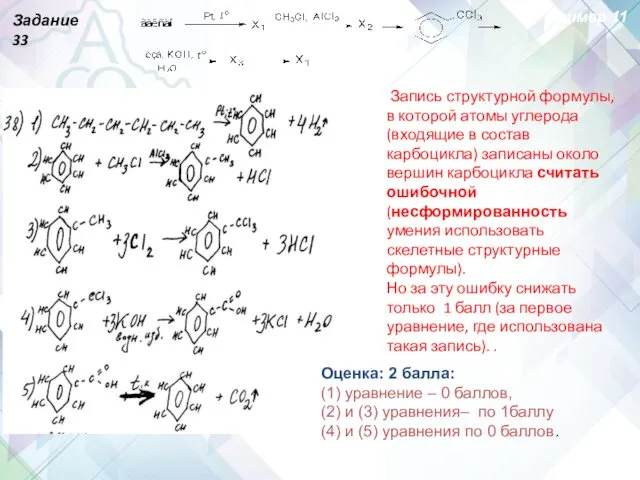
- 65. Задание 33 Пример 12 Оценка: 0 баллов Во всех уравнениях есть ошибка при записи структурных формул
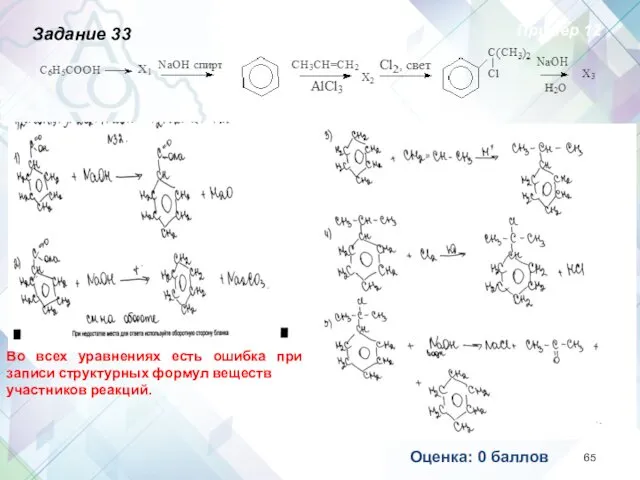
- 66. Оценка 4 балла Пример 28 Задание 33 Уравнение (3) записано неверно (схема вместо уравнения)
- 67. Расчёты массы (объёма, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
- 68. Задание 34
- 69. Для проведения электролиза взяли 390 г 15%-ного раствора хлорида натрия. После того как масса раствора уменьшилась
- 70. Пример 1 4 балла правильно записаны уравнения реакций, соответствующих условию задания; 1 балл правильно произведены вычисления,
- 71. Пример 2 1 балл
- 72. Пример 3 1 балл правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии
- 73. Установление молекулярной и структурной формулы вещества Задание 35
- 74. При сжигании образца органического вещества массой 1,85 г получено 1,68 л (н.у.) углекислого газа и 1,35
- 76. 1 балл Пример 1
- 77. Пример 2 2 балла
- 78. Пример 3 0 баллов
- 79. Соль органической кислоты содержит 4,35 % водорода, 39,13 % углерода, 34,78 % кислорода и 21,74 %
- 80. Пример 4 2 балла
- 81. Пример 5 1 балл
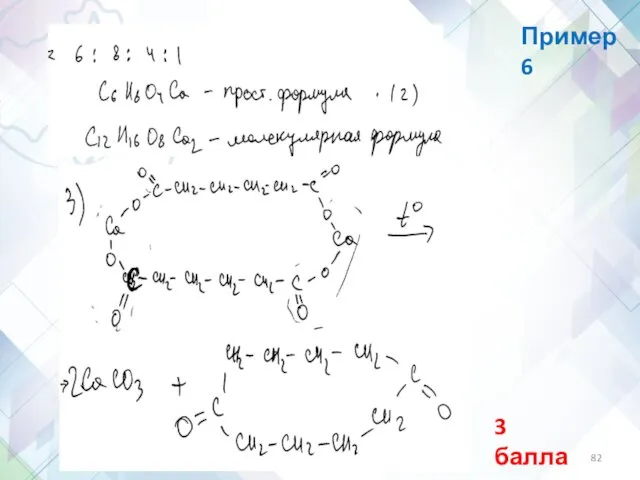
- 82. Пример 6 3 балла
- 83. ЗАДАНИЯ 20-23 ОГЭ 2019
- 84. Особенности заданий для стандартизированной оценки учебных достижений учащихся Строгое соответствие содержания заданий нормативной базе (ФК ГОС
- 85. В экзаменационной работе моделей 1 и 2 первые два задания с развернутым ответом (20 и 21)
- 86. электронный баланс можно считать составленным верно в случае, если любым способом будет показано, что число отданных
- 87. Удвоенные коэффициенты принимаем указание на окислитель и восстановитель, записанное в любом месте, принимаем Принимаем любое оформление
- 88. 1.Писать "Дано" не обязательно в задаче . 2.Приводить расчёт молярной массы вещества не обязательно. 3.Можно запись
- 89. 5.Методом пропорции решать можно, но при этом эксперту должно быть понятно, откуда взялись те или иные
- 90. Наиболее частой ошибкой при решении задачи методом пропорции является неправильная запись молярной массы реагирующих веществ. Неверно
- 91. 6.Записывать уравнение протекающей по условию задачи реакции обязательно. Правильно записанное уравнение реакции оценивается одним баллом. 7.Указывать
- 92. Задание 22 является практико-ориентированным и в модели 2 имеет характер «реального эксперимента». Оно ориентировано на проверку
- 93. Задание 22 Если первой записана реакция, проведение которой невозможно, то дальнейшие записи не оцениваются (за задание
- 94. Записи CO2↑ и AgCl↓ не могут считаться указанием признака реакции: выделения газа или выпадения осадка.
- 95. Задание 22,23 В задание 22 должна быть схема превращений; за ошибки в записях, которые не требуются
- 96. Используемые материалы 1.Добротин Дмитрий Юрьевич Структура и содержание контрольных измерительных материалов по химии в 2019 г.
- 98. Скачать презентацию




















































































 Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3)
Кислотно-основные равновесия в водном растворе. Буферные растворы. (Лекция 3) Сірке қышқылын алу технологиясы
Сірке қышқылын алу технологиясы Основы химической термодинамики
Основы химической термодинамики Выделение низших олефинов. Разделение непредельных газов
Выделение низших олефинов. Разделение непредельных газов Полимеры. Мономер
Полимеры. Мономер Бұл суреттерді не біріктіреді деп ойлайсыздар?
Бұл суреттерді не біріктіреді деп ойлайсыздар? Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати
Теплові явища, що супроводжують розчинення речовин. Розчинення як фізико-хімічний процес. Кристалогідрати Комплексонометрлік титрлеу
Комплексонометрлік титрлеу Стекло. Виды стекол
Стекло. Виды стекол Металлы
Металлы Жидкие кристаллы и их свойства
Жидкие кристаллы и их свойства Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды)
Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды) Обмен липидов
Обмен липидов Аминокислоты. АТФ
Аминокислоты. АТФ Основные классы химических соединений
Основные классы химических соединений Химия өнеркәсібіндегі энергетикалық ресурстар
Химия өнеркәсібіндегі энергетикалық ресурстар Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Химические реакции
Химические реакции Кислород. Атом кислорода
Кислород. Атом кислорода Геохимия литосферы
Геохимия литосферы Химические элементы. Строение вещества. Химическая связь
Химические элементы. Строение вещества. Химическая связь Спекание. Основные типы спекания
Спекание. Основные типы спекания Соединения углерода
Соединения углерода Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов
Основные отличия химии органических производных элементов IV-Б группы от химии переходных элементов Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Химические уравнения
Химические уравнения Функциональные производные карбоновых кислот
Функциональные производные карбоновых кислот Электролитическая диссоциация
Электролитическая диссоциация