Слайд 2

оглавление
Какие количественные характеристики определяют силу электролита?
Опредения сильных и слабых электролитов
Что такое
раствор ?
Что такое электролитическая диссоциация?
И ТАК ДАЛЕЕ
Слайд 3

какие количественные характеристики определяют силу электролита?
количественной характеристикой, определяющей силу электролита, является
СТЕПЕНЬ ДИССОЦИАЦИИ α=C(вещества, подвергшегося диссоциации)/C(начальная)
В расчетах степени диссоциации используют активную или аналитическую концентрацию, активная концентрация – это концентрация свободных частиц.
Аналитическая концентрация – это, например, молярная Cm, единица измерения моль/л (Cm=n/V)
Активная концентрация – та концентрация, которую мы учитываем в рассчетах a=Ci x f,
lg (f)= -1/2 (Zi)^2 x √I
Слайд 4

определения
Сильные электролиты – электролиты, степень диссоциации которых в растворах равна 1,
то есть диссоциируют полностью (сильные кислоты, щелочи, соли).
Слабые электролиты – степень диссоциации меньше единицы (то есть диссоциируют неполностью) и уменьшается с ростом концентрации.
Слайд 5

что такое раствор?
В растворах слабых электролитов степень диссоциации мала, число
катионов и анионов в растворе вследствие неполной диссоциации тоже маленькое CD -> C(+) + D(-)
Число ионов в сильных электролитах больше, следовательно, чем больше концентрация, тем больше ионы электростатически взаимодействуют между собой, при взаимодействии образуются ионные пары C(+)……D(-)
НУЖНО ДОБАВИТЬ ЧТО-ТО, ЗДЕСЬ ПРОСТО ИНФА ИЗ КОНТЕКСТА
Слайд 6






 Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Неравновесные явления в сложных химических процессах. Часть 1: электрохимия
Неравновесные явления в сложных химических процессах. Часть 1: электрохимия Отчет о прохождении производственно-технологической практики
Отчет о прохождении производственно-технологической практики Алкины. Физические и химические свойства
Алкины. Физические и химические свойства Теория электролитической диссоциации
Теория электролитической диссоциации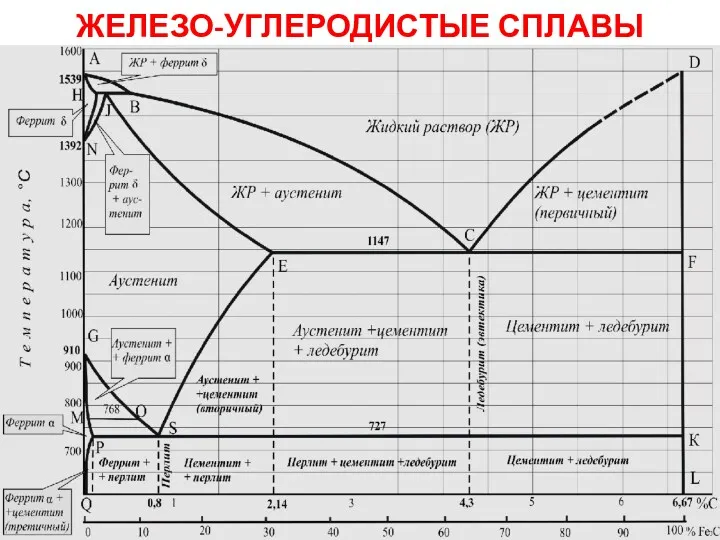 Железо-углеродистые сплавы
Железо-углеродистые сплавы Основные понятия органической химии
Основные понятия органической химии Аминокислоты. Понятие аминокислот
Аминокислоты. Понятие аминокислот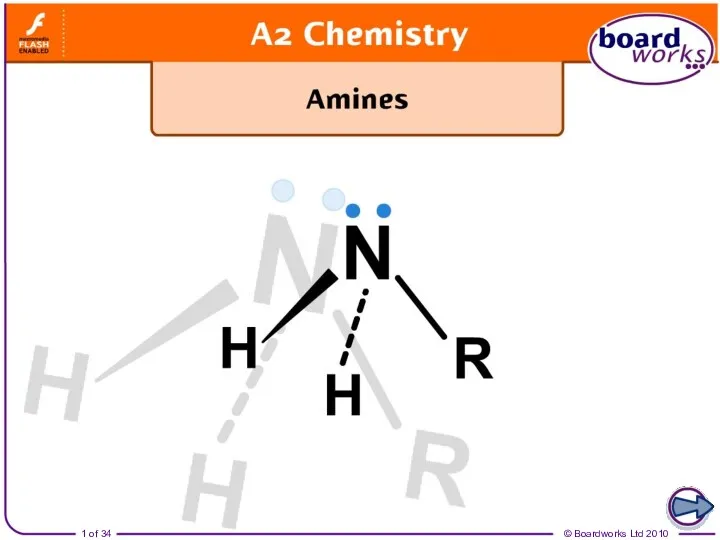 Ammonia and amines
Ammonia and amines Совйства спиртов. 10 класс
Совйства спиртов. 10 класс Кальций. Химиялық қасиеті
Кальций. Химиялық қасиеті Соли, их классификация и свойства
Соли, их классификация и свойства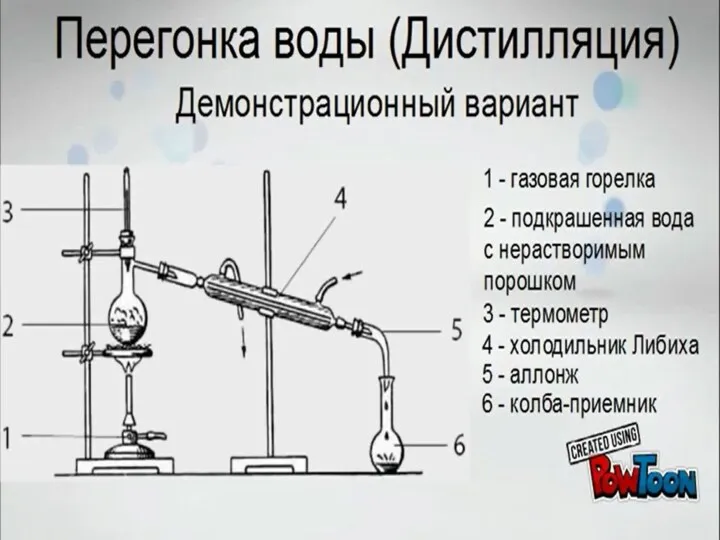 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант Металловедение. Классификация металлов
Металловедение. Классификация металлов Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Состав воздуха. Тема 1
Состав воздуха. Тема 1 Лекарства дома
Лекарства дома Дисперсные системы в медицине и пищевой промышленности
Дисперсные системы в медицине и пищевой промышленности Основания. Гидроксид аммония-NH₃·H₂O
Основания. Гидроксид аммония-NH₃·H₂O Антибиотики как ЛС
Антибиотики как ЛС Химический калейдоскоп. Слайд-газета
Химический калейдоскоп. Слайд-газета Основные понятия химии
Основные понятия химии Положение тугоплавких металлов в Периодической системе элементов
Положение тугоплавких металлов в Периодической системе элементов Полисахариды. Крахмал
Полисахариды. Крахмал Қышқылдық-негіздік тепе-теңдік. Қышқылдар мен негіздердің протологиялық теориясы
Қышқылдық-негіздік тепе-теңдік. Қышқылдар мен негіздердің протологиялық теориясы Соли. Определение солей
Соли. Определение солей Хімічні властивості алканів
Хімічні властивості алканів Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические
Композиционные материалы. Материалы порошковой металлургии: пористые, конструкционные, электротехнические