Содержание
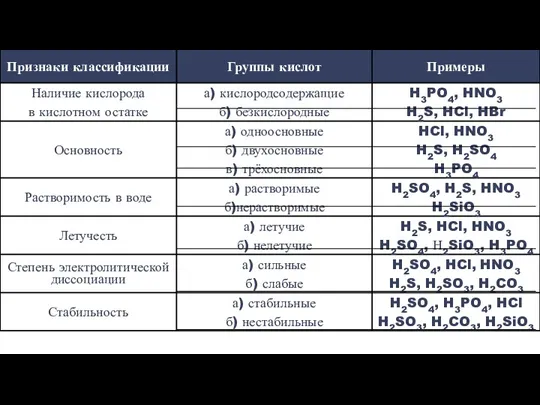
- 3. Кислоты – это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются ионы водорода
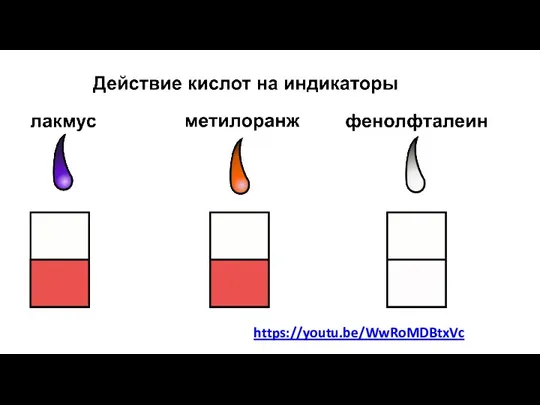
- 4. https://youtu.be/WwRoMDBtxVc
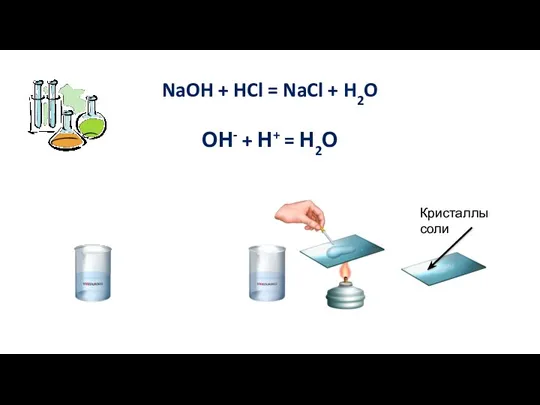
- 5. 2. Реакция с основаниями Кислота + основание = соль + вода Реакция обмена
- 6. NaOH + HCl = NaCl + H2O ОН- + Н+ = Н2О Кристаллы соли
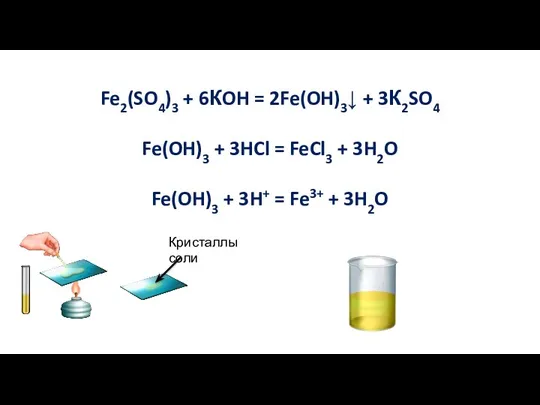
- 7. Fe2(SO4)3 + 6КOH = 2Fe(OH)3↓ + 3К2SO4 Fe(OH)3 + 3HCl = FeCl3 + 3H2O Fe(OH)3 +
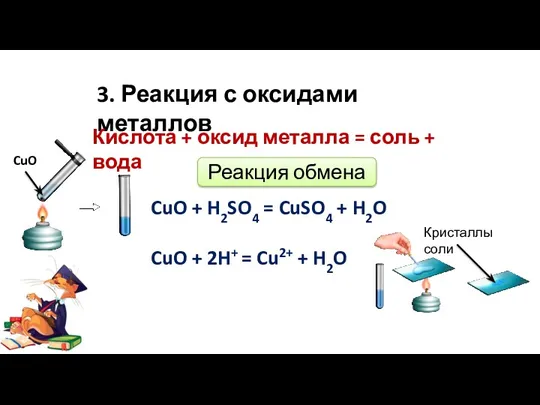
- 8. 3. Реакция с оксидами металлов CuO + H2SO4 = CuSO4 + H2O CuO + 2H+ =
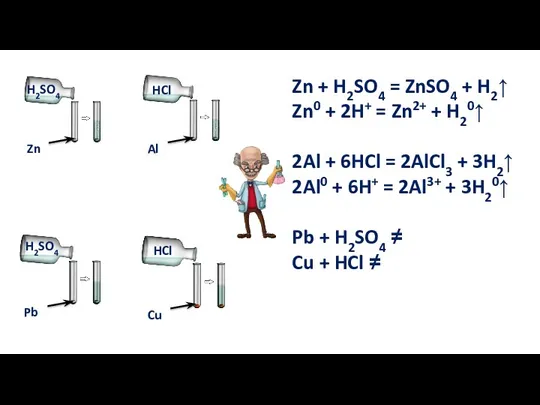
- 9. 4. Реакции с металлами Кислота + металл = соль + водород Реакции замещения
- 10. Для этих реакций необходимы условия: Металл должен находиться в ряду напряжений до водорода; Должна получиться растворимая
- 11. Zn + H2SO4 = ZnSO4 + H2↑ Zn0 + 2H+ = Zn2+ + H20↑ 2Al +
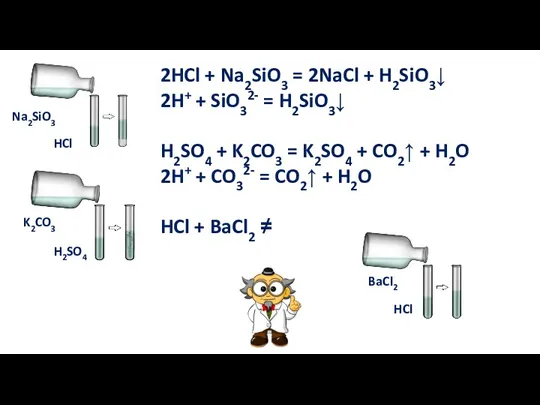
- 12. 5. Реакция с солями Кислота + соль = новая кислота + новая соль Реакция обмена
- 13. 2HCl + Na2SiO3 = 2NaCl + H2SiO3↓ 2H+ + SiO32- = H2SiO3↓ H2SO4 + K2CO3 =
- 14. СВОЙСТВА ОСНОВАНИЙ В СВЕТЕ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
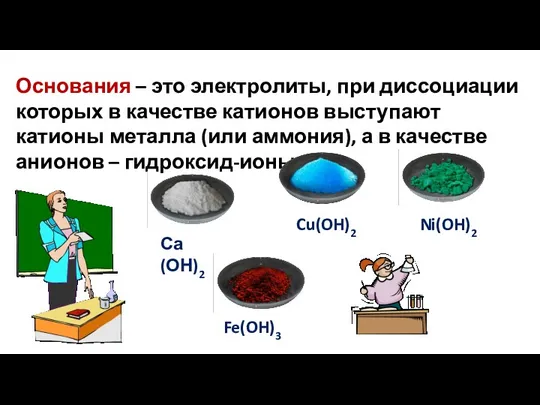
- 15. Основания – это электролиты, при диссоциации которых в качестве катионов выступают катионы металла (или аммония), а
- 16. 1. Диссоциация оснований NaOH = Na+ + OH- https://youtu.be/WwRoMDBtxVc
- 17. 2. Реакции оснований с кислотами (реакции обмена) Основание + кислота = соль + вода NaOH +
- 18. 3. Реакции оснований с оксидами неметаллов (реакции обмена) Основание + оксид неметалла = соль + вода
- 19. 4. Реакции оснований с солями (реакции обмена) Основание + соль = новая соль + новое основание
- 20. NaOH + NH4Cl = NaCl + NH3↑ + H2O OH- + NH4+ = NH3↑ + H2O
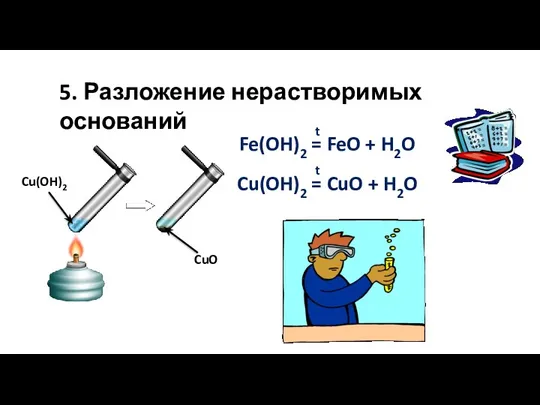
- 21. 5. Разложение нерастворимых оснований Fe(OH)2 = FeO + H2O t Cu(OH)2 = CuO + H2O t
- 23. Амфотерность — это способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от
- 24. Взаимодействие амфотерных оксидов со щелочами Al2О3 + 2NaOH = 2NaAlO2 + H2O В реакции между оксидом
- 26. Скачать презентацию










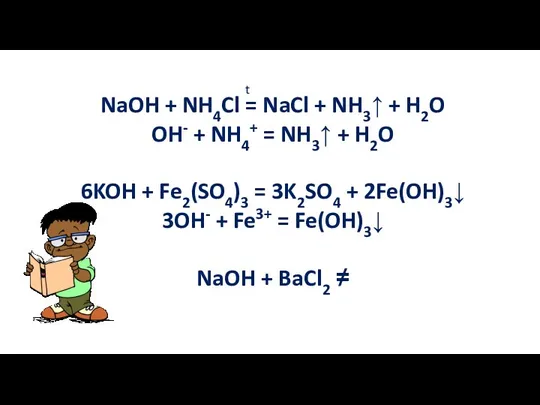



 Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Хімічні властивості металів
Хімічні властивості металів Techniques for preparation of gaseous samples with a desired concentration of analyte
Techniques for preparation of gaseous samples with a desired concentration of analyte НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Гидроксид магния. Mg(OH)2
Гидроксид магния. Mg(OH)2 Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Вуглеводи
Вуглеводи Cromatografia ionică
Cromatografia ionică Аналитические методы
Аналитические методы Каталитический риформинг
Каталитический риформинг циклоалканы170
циклоалканы170 Современные тенденции развития химии
Современные тенденции развития химии Термодинамика
Термодинамика Комплексные соединения
Комплексные соединения Алкины. Ацетилен (Этин) – С2Н2
Алкины. Ацетилен (Этин) – С2Н2 Катализ и катализаторы
Катализ и катализаторы Тепловой эффект химической реакции. 11 класс
Тепловой эффект химической реакции. 11 класс Непредельные углеводороды ряда этилена
Непредельные углеводороды ряда этилена Предмет аналитической химии, ее структура
Предмет аналитической химии, ее структура Ионы. Проверочная работа
Ионы. Проверочная работа Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии Химическая связь
Химическая связь Аммиак
Аммиак Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Алкины. 10 класс
Алкины. 10 класс Химическая связь в твердых веществах и жидкостях
Химическая связь в твердых веществах и жидкостях ae2db93272ef42dba476a56bbc56b895
ae2db93272ef42dba476a56bbc56b895