Содержание
- 2. Цели урока Знать: строение алкенов, характерные типы химических реакций (реакции присоединения, полимеризации, окисления), применение алкенов на
- 3. Понятие об алкенах Алкены – углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а
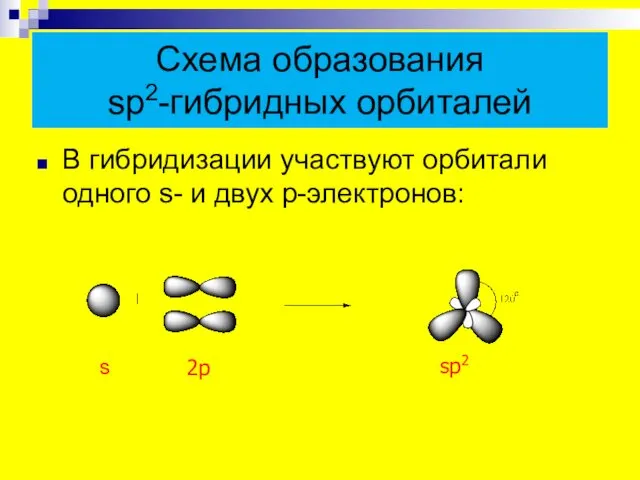
- 4. Схема образования sp2-гибридных орбиталей В гибридизации участвуют орбитали одного s- и двух p-электронов: s 2p sp2
- 5. Гомологический ряд алкенов Этен Пропен Бутен Пентен Гексен Гептен C2H4 C3H6 C4H8 C5H10 C6H12 C7H14 Общая
- 6. Изомерия алкенов Для алкенов возможны два типа изомерии: 1-ый тип – структурная изомерия: углеродного скелета положения
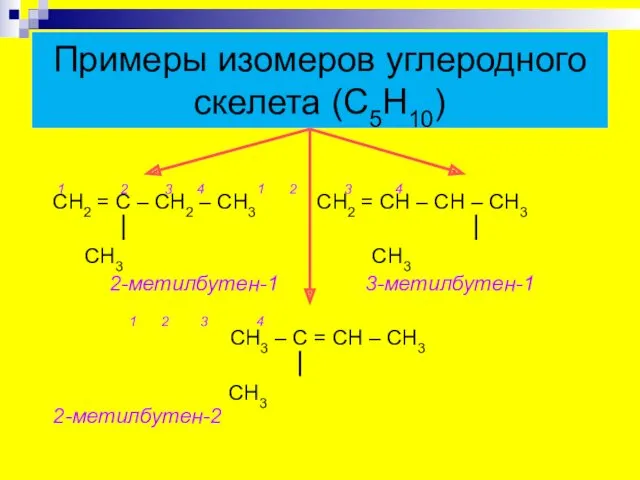
- 7. Примеры изомеров углеродного скелета (С5Н10) 1 2 3 4 1 2 3 4 СН2 = С
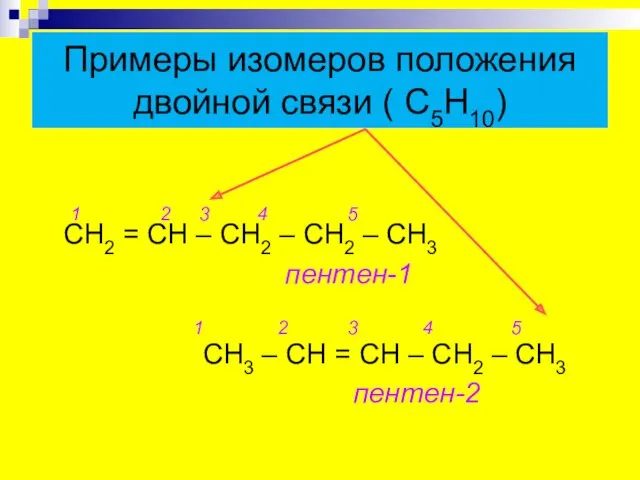
- 8. Примеры изомеров положения двойной связи ( С5Н10) 1 2 3 4 5 СН2 = СН –
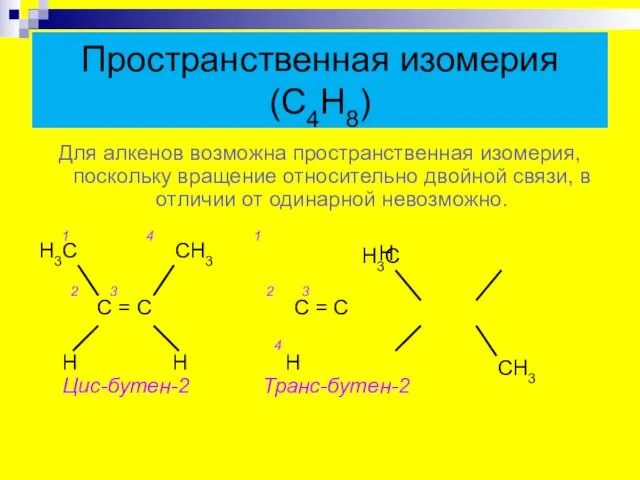
- 9. Пространственная изомерия (С4Н8) Для алкенов возможна пространственная изомерия, поскольку вращение относительно двойной связи, в отличии от
- 10. Геометрические изомеры бутена Цис-изомер Транс-изомер
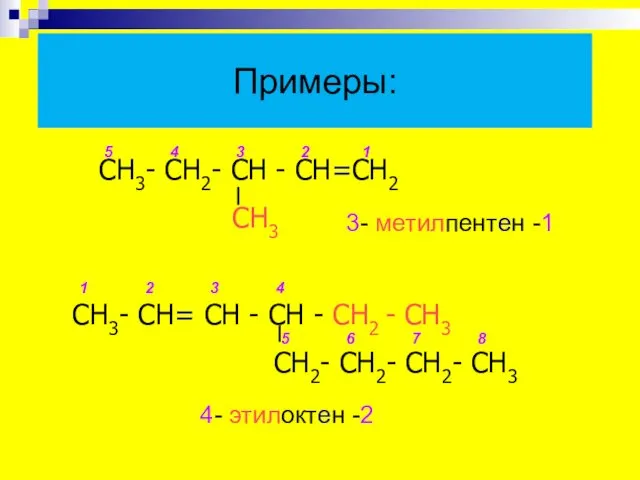
- 11. Примеры: 4- этилоктен -2 СН3- СН2- СН - СН=СН2 СН3 СН3- СН= СН - СН -
- 12. Физические свойства алкенов Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях. С2– С4
- 13. Химические свойства алкенов По химическим свойствам алкены резко отличаются от алканов. Алкены более химически активные вещества,
- 14. Типы химических реакций, которые характерны для алкенов Реакции присоединения. Реакции полимеризации. Реакции окисления.
- 15. Реакции присоединения 1. Гидрирование. CН2 = СН2 + Н2 СН3 – СН3 Этен этан Условия реакции:
- 16. Реакции присоединения 3. Гидрогалогенирование. 1 2 3 4 1 2 3 4 СН2 = СН –
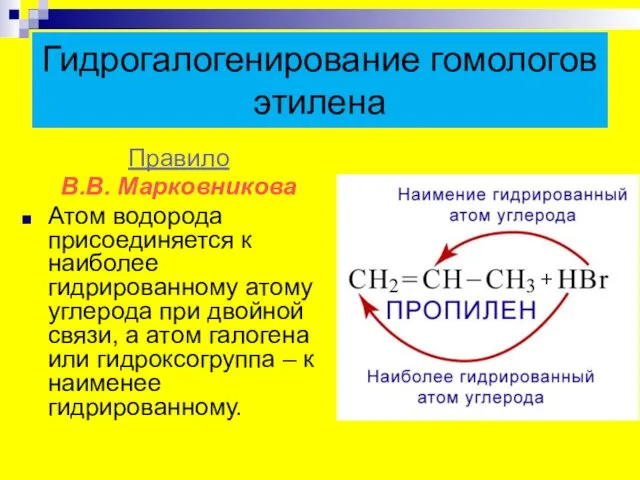
- 17. Гидрогалогенирование гомологов этилена Правило В.В. Марковникова Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной
- 18. Реакции полимеризации (свободно-радикальное присоединение) Полимеризация – это последовательное соединение одинаковых молекул в более крупные. σ σ
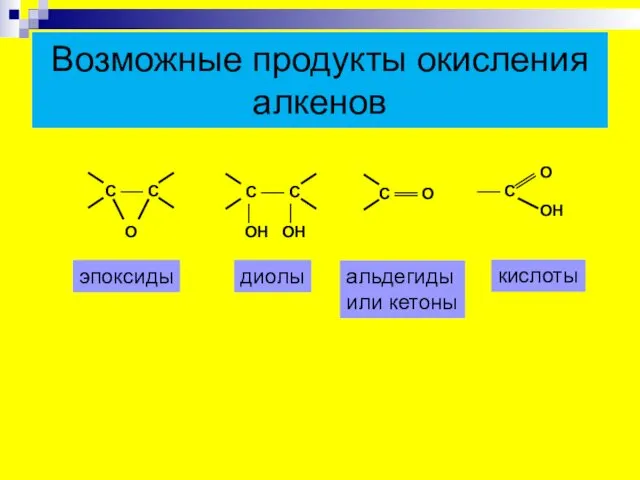
- 19. Возможные продукты окисления алкенов эпоксиды диолы альдегиды или кетоны кислоты
- 20. Реакции окисления Реакция Вагнера. (Мягкое окисление раствором перманганата калия). 3СН2 = СН2 + 2КМnО4 + 4Н2О
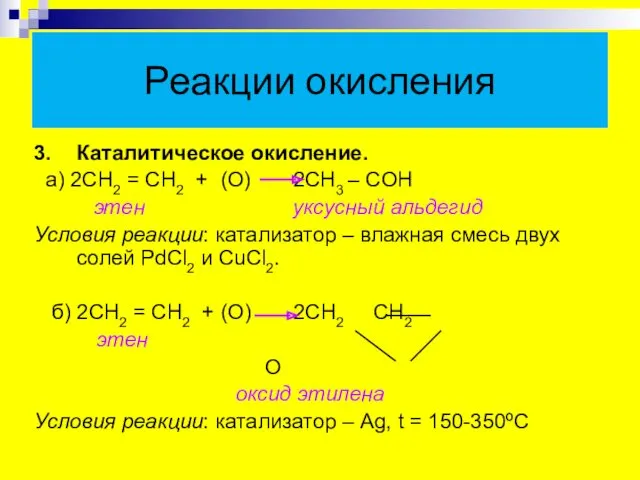
- 21. Реакции окисления 3. Каталитическое окисление. а) 2СН2 = СН2 + (О) 2СН3 – CОН этен уксусный
- 22. Горение алкенов Алкены горят красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое. Массовая
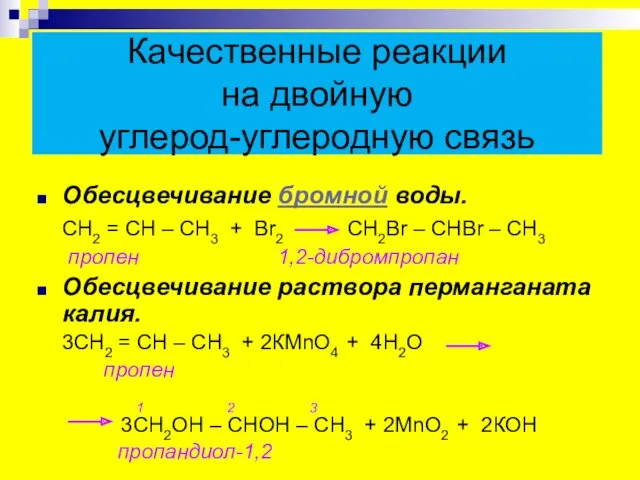
- 23. Качественные реакции на двойную углерод-углеродную связь Обесцвечивание бромной воды. СН2 = СН – СН3 + Вr2
- 24. Применение Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры
- 25. Это интересно Всем известный полиэтилен был получен был получен в 1933 году Э. Фосеттом и Р.
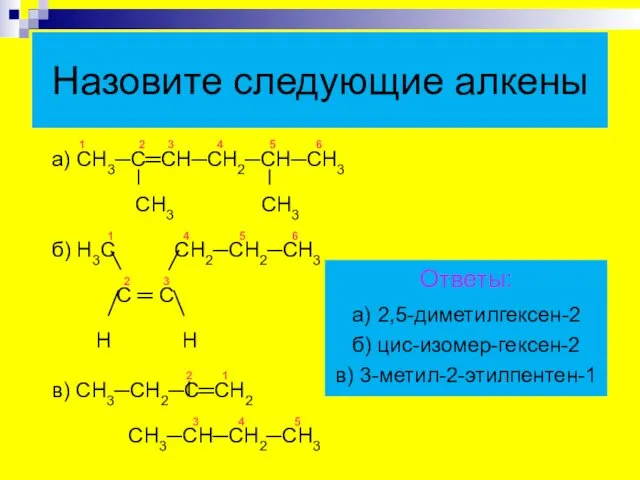
- 26. 1 2 3 4 5 6 а) СН3─С═СН─СН2─СН─СН3 СН3 СН3 1 4 5 6 б) Н3С
- 27. а) СН3-СН=СН2 + НСl → ? б) СН2=СН-СН2-СН3 + НBr → ? В) СН3-СН2-СН=СН2 + НОН
- 29. Скачать презентацию
















 Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування Катионы IV аналитической группы
Катионы IV аналитической группы Строение атома и периодический закон. (Тема 2)
Строение атома и периодический закон. (Тема 2) Қазақстанда химияны оқыту әдістемесінің даму тарихы
Қазақстанда химияны оқыту әдістемесінің даму тарихы Химическая промышленность
Химическая промышленность Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання Кислород/водород. Повторение
Кислород/водород. Повторение Лаборатория красивых волос
Лаборатория красивых волос Аммиак (9 класс)
Аммиак (9 класс) ферментер
ферментер Гидролиз солей
Гидролиз солей Химические свойства и получение алканов
Химические свойства и получение алканов Механическая смесь и растворы
Механическая смесь и растворы Химическая связь и ее типы. Кристаллические решётки
Химическая связь и ее типы. Кристаллические решётки Массовая доля элемента в веществе
Массовая доля элемента в веществе Цинк и его применение
Цинк и его применение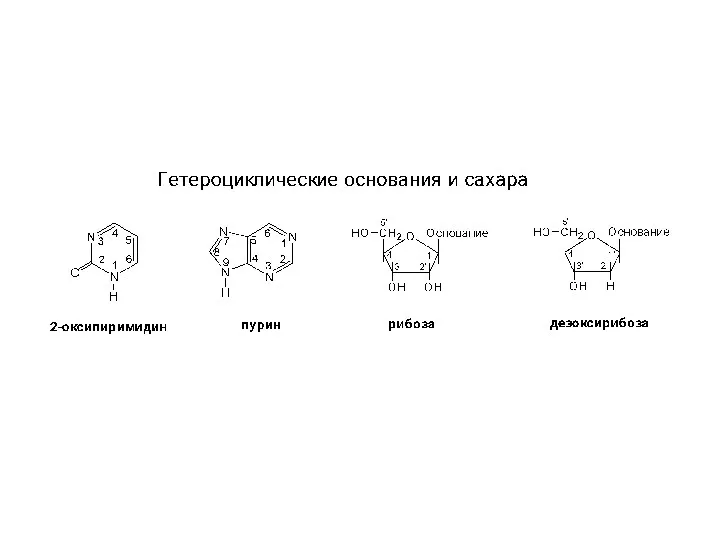 Структура гетероциклов, нуклеозидов и нуклеотидов
Структура гетероциклов, нуклеозидов и нуклеотидов Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Пластические массы и изделия на их основе
Пластические массы и изделия на их основе Химические уравнения
Химические уравнения p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Тотығу-тотықсыздану титрлеу әдісі
Тотығу-тотықсыздану титрлеу әдісі Химическая связь в кластерах
Химическая связь в кластерах Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Ionic polymerization
Ionic polymerization