Содержание
- 2. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Действие группового
- 3. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Действие группового
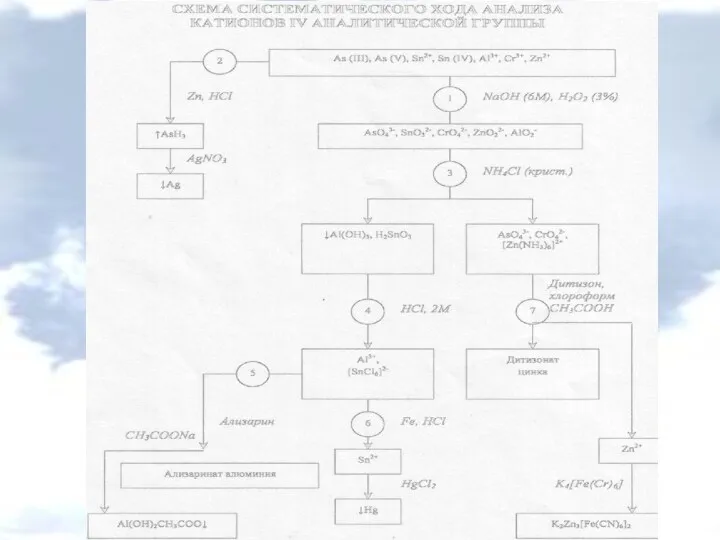
- 4. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Реакции ионов
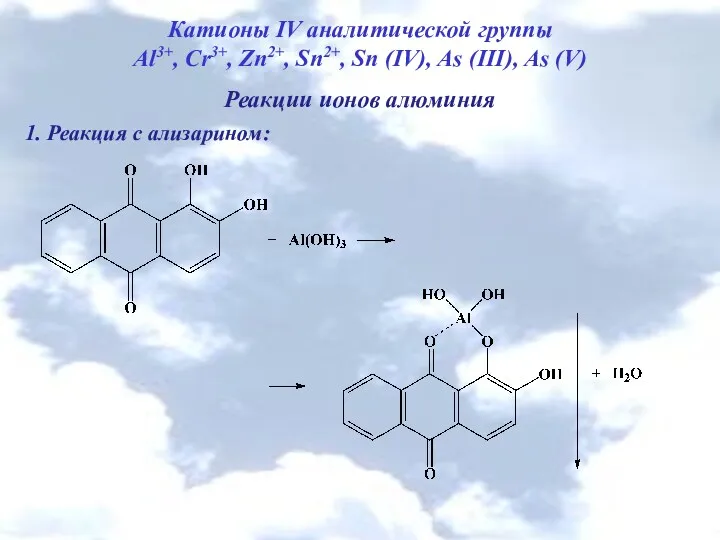
- 5. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Реакции ионов
- 6. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Реакции ионов
- 7. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Реакции ионов
- 8. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Реакции ионов
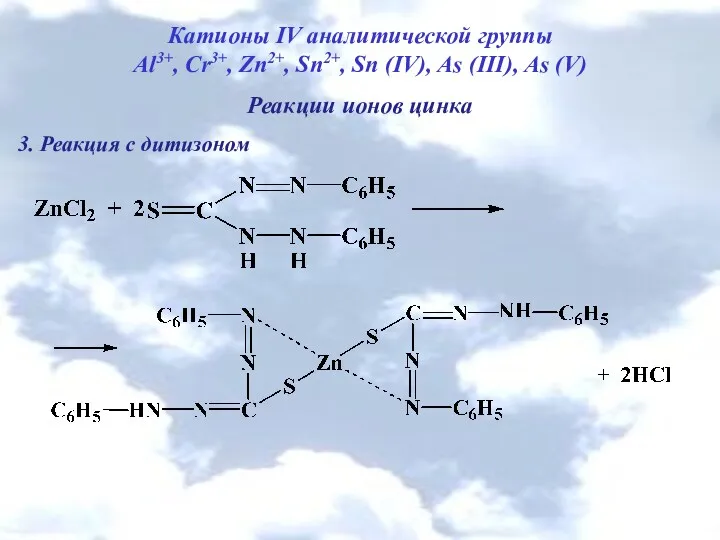
- 9. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Реакции ионов
- 10. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Реакции ионов
- 11. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Реакции ионов
- 12. Катионы IV аналитической группы Al3+, Cr3+, Zn2+, Sn2+, Sn (IV), As (III), As (V) Реакции ионов
- 14. КАТИОНЫ V АНАЛИТИЧЕСКОЙ ГРУППЫ
- 15. Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb (V), Bi3+ Групповой реагент концентрированный
- 16. Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb (V), Bi3+ Na[SbCl6] + 5NH3⋅H2O
- 17. Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb (V), Bi3+ Реакция ионов магния
- 18. Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb (V), Bi3+ Реакции ионов железа
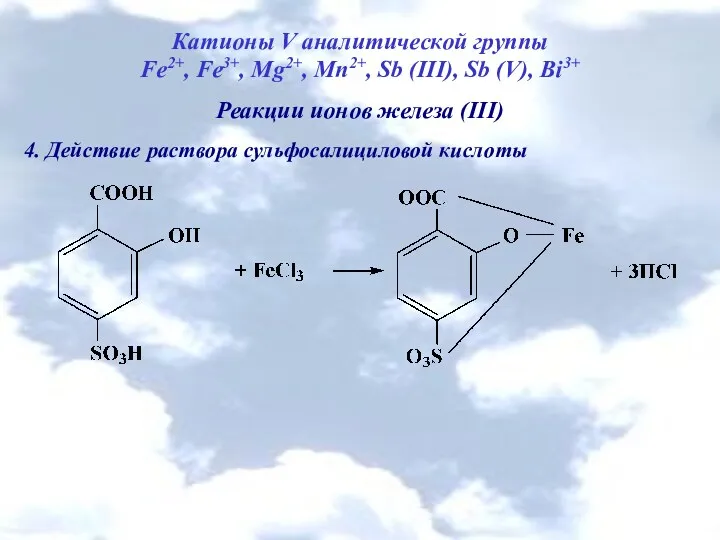
- 19. Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb (V), Bi3+ Реакции ионов железа
- 20. Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb (V), Bi3+ Реакции ионов марганца
- 21. Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb (V), Bi3+ Реакции ионов висмута
- 22. Катионы V аналитической группы Fe2+, Fe3+, Mg2+, Mn2+, Sb (III), Sb (V), Bi3+ Реакции ионов висмута
- 23. КАТИОНЫ VI АНАЛИТИЧЕСКОЙ ГРУППЫ
- 24. Катионы VI аналитической группы Cu2+, Hg2+, Co2+, Ni2+ Групповой реагент избыток концентрированного раствора аммиака (NH3·H2O). В
- 25. Катионы VI аналитической группы Cu2+, Hg2+, Co2+, Ni2+ HgCl2 + 2NH3⋅H2O → → HgNH2Cl↓ + NH4Cl
- 26. Катионы VI аналитической группы Cu2+, Hg2+, Co2+, Ni2+ CoCl2 + NH3⋅H2O → CoOHCl↓ + NH4Cl CoOHCl↓
- 27. Катионы VI аналитической группы Cu2+, Hg2+, Co2+, Ni2+ Реакции ионов ртути (II) 2. Действие раствора олова
- 28. Катионы VI аналитической группы Cu2+, Hg2+, Co2+, Ni2+ Реакции ионов кобальта 1. Действие раствора аммония тиоцианата
- 29. Катионы VI аналитической группы Cu2+, Hg2+, Co2+, Ni2+ Реакции ионов меди Действие раствора аммиака NH3⋅H2O CuSO4
- 31. Скачать презентацию
























 Основные классы неорганических соединений
Основные классы неорганических соединений Процесс электролиза
Процесс электролиза Атомы, молекулы и ионы
Атомы, молекулы и ионы Мыла и синтетические моющие средства
Мыла и синтетические моющие средства Глицерин. Свойства и применение
Глицерин. Свойства и применение Основания
Основания Типы химических реакций
Типы химических реакций Каликсарены
Каликсарены Щелочные металлы
Щелочные металлы Соли: получение, применение
Соли: получение, применение Химические явления. Горение. 5 класс
Химические явления. Горение. 5 класс Поверхностная модификация дисперсных систем
Поверхностная модификация дисперсных систем Реакции ионного обмена
Реакции ионного обмена Определение химического элемента на основании расчетов по химическим реакциям
Определение химического элемента на основании расчетов по химическим реакциям Приемы обращения с лабораторным оборудованием
Приемы обращения с лабораторным оборудованием Аммиак. Физические и химические свойства. Получение, применение
Аммиак. Физические и химические свойства. Получение, применение АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ.
АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ. Строение атома углерода. Валентные состояния атома углерода
Строение атома углерода. Валентные состояния атома углерода Строение вещества. Химическая связь
Строение вещества. Химическая связь Химическая посуда
Химическая посуда Introduction to Biochemistry
Introduction to Biochemistry Аминокислоты. Белки
Аминокислоты. Белки Кластер Химические реакции
Кластер Химические реакции Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Сложные эфиры. Жиры
Сложные эфиры. Жиры Вещества и материалы. Классификация веществ. Реакции нейтрализации
Вещества и материалы. Классификация веществ. Реакции нейтрализации бензол
бензол Классификация химических элементов
Классификация химических элементов