Содержание
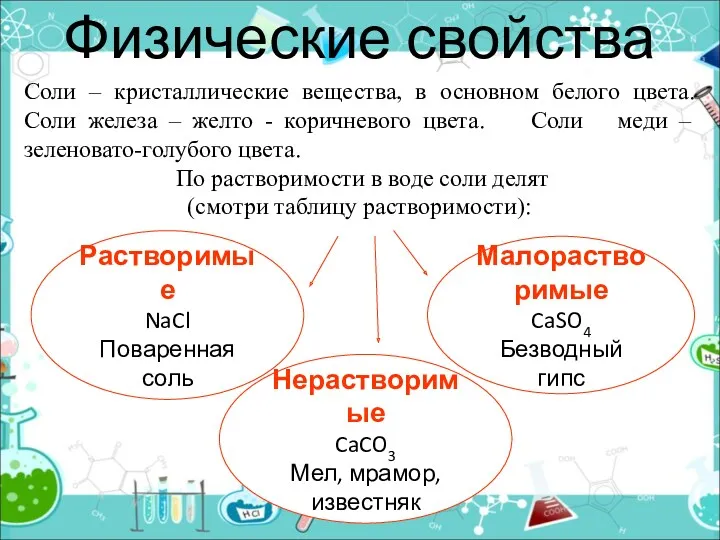
- 2. Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа
- 3. Химические свойства 1. Взаимодействие с металлами. Каждый левее стоящий металл в ряду напряжений вытесняет последующий из
- 4. Химические свойства 2. Взаимодействие со щелочами: В результате обязательно должно образоваться нерастворимое основание. 3. Взаимодействие солей
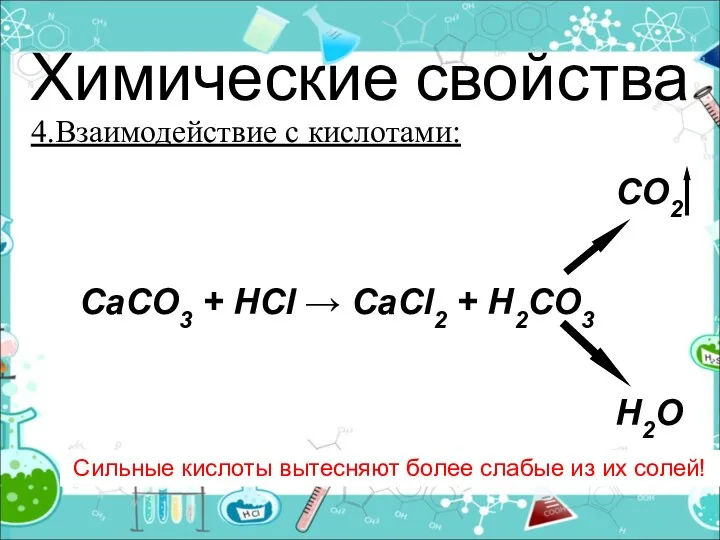
- 5. Химические свойства 4.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO2 CaCO3 +
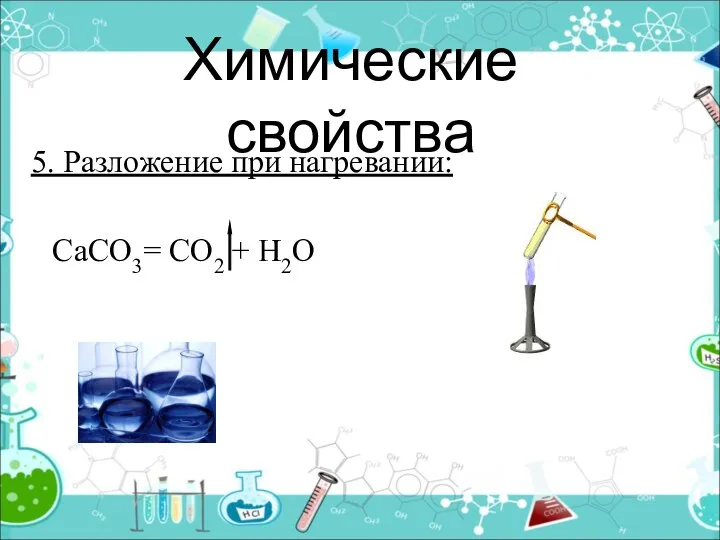
- 6. Химические свойства 5. Разложение при нагревании: СаСО3= СО2 + Н2О
- 7. Способы получения 1. Кислота + основание = соль + вода H2SO4 +2NaOH = Na2SO4 + 2H2O
- 8. Способы получения 5. Основание + соль = новое основание + новая соль 2КОН + СаSO4 =
- 9. Применение солей Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид
- 10. Применение солей Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при
- 11. Применение солей Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим
- 12. Применение солей Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия
- 13. О соли Мёртвое море
- 14. Розовое озеро в Сенегале Это озеро имеет такой цвет из-за большого количества микроорганизмов и полезных ископаемых.
- 15. Самое большое солевое озеро в мире расположено на юге пустынной равнины Альтиплано, в Боливии, на высоте
- 17. Скачать презентацию











 Природные источники углеводородов
Природные источники углеводородов Застосування неметалів
Застосування неметалів Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Спирты & Фенолы
Спирты & Фенолы Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Относительные атомные и молекулярные массы
Относительные атомные и молекулярные массы Физические свойства минералов
Физические свойства минералов Органическая химия. ДО. Глицерин как представитель многоатомных спиртов
Органическая химия. ДО. Глицерин как представитель многоатомных спиртов Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация
Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация Плотность нефти и нефтепродуктов
Плотность нефти и нефтепродуктов Соли. 11 класс
Соли. 11 класс Минерал турмалин
Минерал турмалин Основания. Гидроксид аммония-NH₃·H₂O
Основания. Гидроксид аммония-NH₃·H₂O Элемент цинк
Элемент цинк Дисперсные (коллоидные) системы и растворы
Дисперсные (коллоидные) системы и растворы Неравновесные явления в сложных химических процессах. Часть 1: электрохимия
Неравновесные явления в сложных химических процессах. Часть 1: электрохимия Химический элемент вольфрам
Химический элемент вольфрам Растворы ВМС
Растворы ВМС Chem reactions. Different Typesof Chemical Reactions
Chem reactions. Different Typesof Chemical Reactions Ферменты и гормоны. (10-11 класс)
Ферменты и гормоны. (10-11 класс) Розв’язування експериментальних задач (9 клас)
Розв’язування експериментальних задач (9 клас) Мембранный транспорт ионов: электродиффузионная теория
Мембранный транспорт ионов: электродиффузионная теория Алкины. Номенклатура и изомерия
Алкины. Номенклатура и изомерия Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Складні білки
Складні білки Витамин С. Физико-химические свойства витамина С
Витамин С. Физико-химические свойства витамина С Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу