Содержание
- 2. МЕТА УРОКУ Закріпити знання про умови перебігу реакцій йонного обміну в розчинах електролітів до кінця. Удосконалювати
- 3. ПОВТОРЮЄМО НАЙГОЛОВНІШЕ 1. У яких випадках реакції йонного обміну відбуваються до кінця? 2. Яких правил потрібно
- 4. 3. Довести наявність йонів гідрогену (Н+) можна за допомогою: 1) Фенолфталеїну 2) Лакмусу 3) Аргентум нітрату
- 5. 4. Довести наявність гідроксид- йонів (ОН- ) можна за допомогою: 1) Фенолфталеїну 2) Кислоти 3) Активного
- 6. 5 .Довести наявність хлорид-іонів (СІ-) можна за допомогою: 1) Натрій гідроксиду (NaOH) 2) Лакмусу 3) Аргентум
- 7. 6 .Довести наявність сульфат-іонів (SO42-) можна за допомогою: 1) Натрій гідроксиду (NaOH) 2) Метилоранжу 3) Аргентум
- 8. 7. Довести наявність карбонат-іонів (СO32-) можна за допомогою: 1) Натрій гідроксиду (NaOH) 2) Лакмусу 3) Будь
- 9. ВИКОНАННЯ ПРАКТИЧНОЇ РОБОТИ Працюємо за інструкцією до практичної роботи № 2 Тема. «Розв’язування експериментальних задач»
- 10. РЕАКТИВИ І ОБЛАДНАННЯ Розчини солей: барій хлорид(ВаCl2), барій нітрат (Ba(NO3)2 , натрій сульфат(Na2SO4) , натрій хлорид
- 11. ПОВТОРЕННЯ ПРАВИЛ ТЕХНІКИ БЕЗПЕКИ В КАБІНЕТІ ХІМІЇ
- 12. Задача 1 Використовуючи реактиви, які є на столі, виконайте реакції, що відповідають таким скороченим йонним рівнянням:
- 13. ЩО І ЯК РОБИТИ? ВИКОНУЄМО ПЕРШЕ ЗАВДАННЯ ІЗ ЗАДАЧІ №1: Підбираємо реактиви. Один має мати в
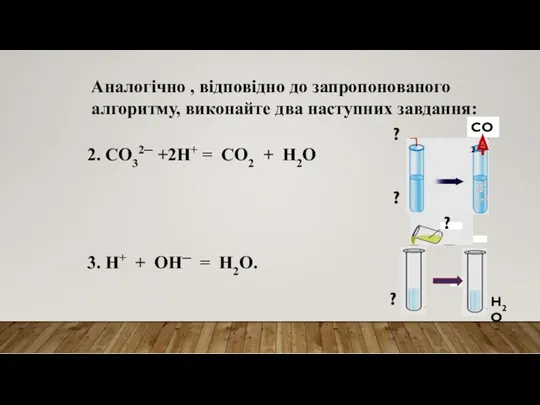
- 14. Аналогічно , відповідно до запропонованого алгоритму, виконайте два наступних завдання: 2. CO32─ +2H+ = CO2 +
- 15. Задача 2 Використовуючи реактиви, які є на столі, добудьте реакцією обміну наступні речовини: Алюміній гідроксид (Al
- 16. ЩО І ЯК РОБИТИ? ВИКОНУЄМО ПЕРШЕ ЗАВДАННЯ ІЗ ЗАДАЧІ №2: Підбираємо реактиви. Один має мати в
- 17. Аналогічно , відповідно до запропонованого алгоритму, виконайте два наступних завдання: 2. Кальцій карбонат (СаСО3); 3. Карбон
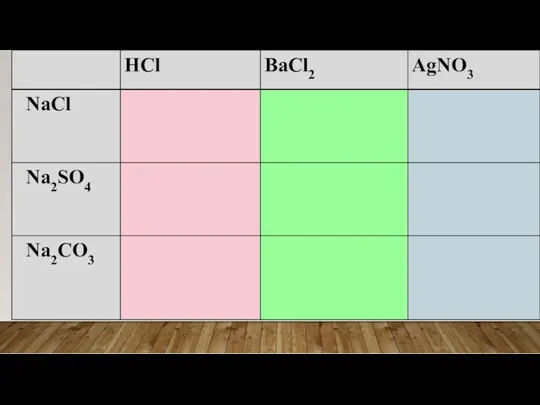
- 18. Задача 3 У трьох пронумерованих пробірках містяться розчини таких речовин: натрій хлорид, натрій сульфат, натрій карбонат.
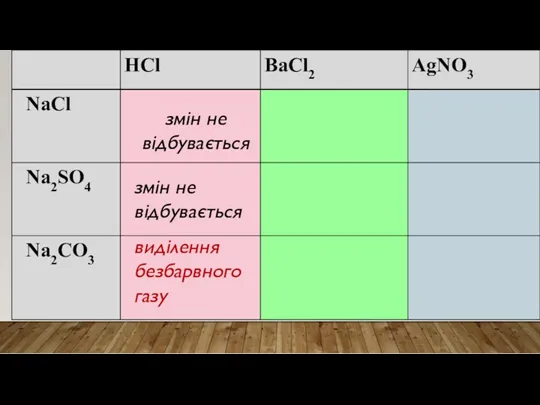
- 20. ХІД РОБОТИ Відливаю у три пробірки по 2 мл кожної з речовин До кожної речовини додаю
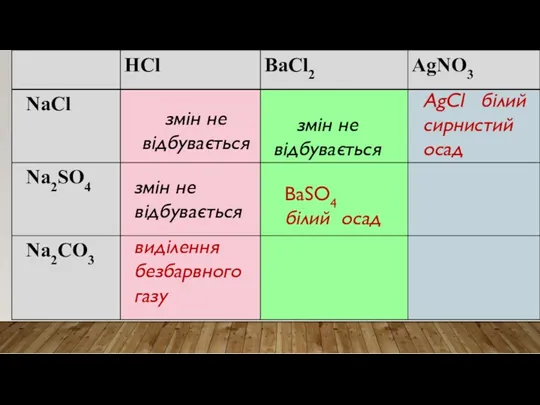
- 21. змін не відбувається змін не відбувається виділення безбарвного газу
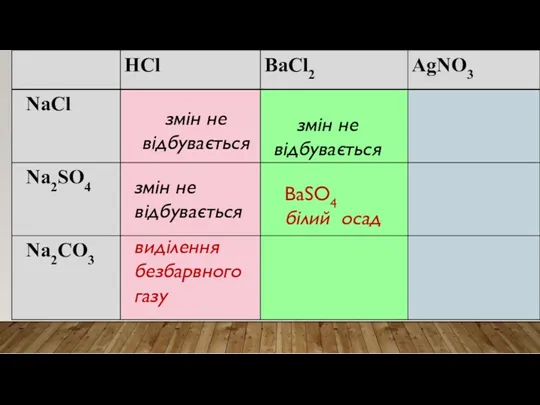
- 22. До речовин під номерами 1 і 2 доливаю розчин барій хлориду. Спостерігаю: в першій пробірці видимих
- 23. змін не відбувається змін не відбувається виділення безбарвного газу змін не відбувається BaSO4 білий осад
- 24. Щоб довести, що в пробірці під номером 1 залишився натрій хлорид NaCl, доливаю розчин аргентум нітрату
- 25. змін не відбувається змін не відбувається виділення безбарвного газу змін не відбувається BaSO4 білий осад AgCl
- 26. Домашнє завдання Повторити матеріал з теми «Електролітична дисоціація» § 3-13 вправа №12 ст.73
- 28. Скачать презентацию




















 Элемент свинец Рb
Элемент свинец Рb Распространенные названия некоторых неорганических веществ
Распространенные названия некоторых неорганических веществ Энергетика химических процессов
Энергетика химических процессов Углеводы. Общая характеристика углеводов
Углеводы. Общая характеристика углеводов Химия титанорганических соединений
Химия титанорганических соединений Геохимия гранитоидов, зоны гипергенеза, осадочного процесса
Геохимия гранитоидов, зоны гипергенеза, осадочного процесса Метанол. Фізичні властивості
Метанол. Фізичні властивості Электронное строение атома. Периодический закон
Электронное строение атома. Периодический закон Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Занимательная химия. Химический элемент. 8 класс
Занимательная химия. Химический элемент. 8 класс Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Органические производные титана со связями Ti-O-C. Получение и свойства. Полимеры на их основе
Органические производные титана со связями Ti-O-C. Получение и свойства. Полимеры на их основе Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Твердое состояни вещества
Твердое состояни вещества Химические связи в органических соединениях
Химические связи в органических соединениях Химические явления. Горение. 5 класс
Химические явления. Горение. 5 класс Природні джерела вуглеводнів. Нафта
Природні джерела вуглеводнів. Нафта Дисперсные системы: общая характеристика и классификация
Дисперсные системы: общая характеристика и классификация Состав и классификация магматических горных пород
Состав и классификация магматических горных пород Понятие об алкинах
Понятие об алкинах Фенол. Феноловая катастрофа
Фенол. Феноловая катастрофа Химия аминокислот, пептидов и белков
Химия аминокислот, пептидов и белков Растворение. Растворы
Растворение. Растворы Молекулы и атомы (часть 2)
Молекулы и атомы (часть 2) Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Хімія та побут
Хімія та побут Аминокислоты, как структурные компоненты белков
Аминокислоты, как структурные компоненты белков Классификация, номенклатура, изомерия органических соединений
Классификация, номенклатура, изомерия органических соединений