Слайд 2

Что такое химическая связь?
Под химической связью в химии понимается взаимное сцепление
атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Слайд 3

Типы химических связей
Ковалентная
Полярная
Неполярная
Ионная
Водородная
Металлическая
Слайд 4
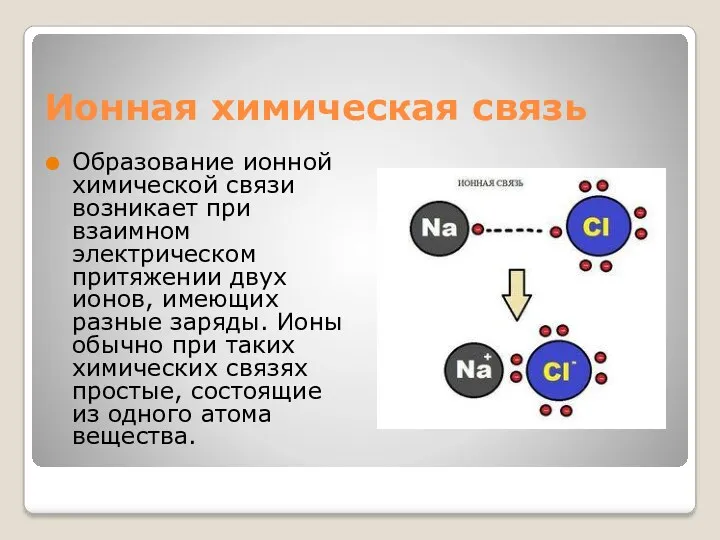
Ионная химическая связь
Образование ионной химической связи возникает при взаимном электрическом притяжении
двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.
Слайд 5

Особенности ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие
у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
Слайд 6

Водородная химическая связь
Еще задолго до появления современной теории химических связей в
ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи
Слайд 7

Водородная химическая связь
Природа и свойства водородной химической связи обусловлены способностью атома
водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Слайд 8

Металлическая химическая связь
У металлов есть свой собственный тип химической связи –
атомы всех металлов расположены определенным образом. Порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.
Слайд 9

Ковалентная связь
Ковалентная связь — это связь между атомами неметаллов, образованная за
счёт общих электронных пар.
Ковалентная связь образуется при взаимодействии неметаллов. Атомы неметаллов имеют высокую электроотрицательность и стремятся заполнить внешний электронный слой за счёт чужих электронов. Два таких атома могут перейти в устойчивое состояние, если объединят свои электроны.
Слайд 10

Ковалентная неполярная связь
Ковалентная неполярная связь соединяет атомы в простых веществах неметаллах.









 Автомобильные бензины
Автомобильные бензины Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Calcium and magnesium. Formation of calcareous.water hardness
Calcium and magnesium. Formation of calcareous.water hardness Биологически важные гетероциклы
Биологически важные гетероциклы Кристаллическое состояние вещества
Кристаллическое состояние вещества Ретросинтез Wickerol A
Ретросинтез Wickerol A Anionic Polymerization
Anionic Polymerization Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Электролитическая диссоциация химических элементов
Электролитическая диссоциация химических элементов Углерод. Общая характеристика элементов подгруппы углерода
Углерод. Общая характеристика элементов подгруппы углерода 530f2c0b0bb94f3085ed9ef5fc682ddb
530f2c0b0bb94f3085ed9ef5fc682ddb Ароматические углеводороды. Процессы производства. Направления использования
Ароматические углеводороды. Процессы производства. Направления использования Гетероатомные соединения нефти
Гетероатомные соединения нефти Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Виды коррозии
Виды коррозии Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Алициклді көмірсутекті қосылыстар
Алициклді көмірсутекті қосылыстар Сложные эфиры. 10 класс
Сложные эфиры. 10 класс Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Альдегиды и кетоны
Альдегиды и кетоны Лекции по курсу конструкционные и биоматериалы
Лекции по курсу конструкционные и биоматериалы Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Water
Water Изучение свойств горных пород, минералов и полезных ископаемых
Изучение свойств горных пород, минералов и полезных ископаемых