Содержание
- 2. Атом А́том— наименьшая часть химического элемента, являющаяся носителем его свойств. Ядро атома состоит из положительно заряженных
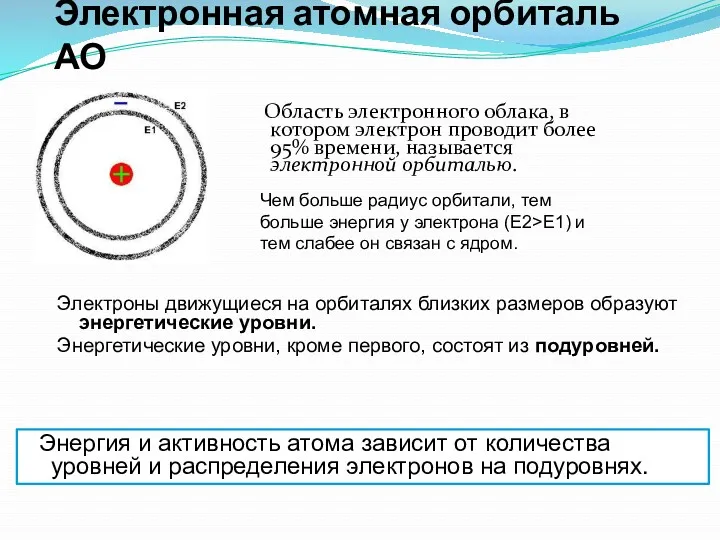
- 3. Электронная атомная орбиталь АО Область электронного облака, в котором электрон проводит более 95% времени, называется электронной
- 4. Квантовые числа Главное квантовое число n Орбитальное квантовое число l Магнитное квантовое число m Спиновое квантовое
- 5. Главное квантовое число Главное квантовое число может принимать положительные целочисленные значения: n=1, 2, 3,..7..,∞ Главное квантовое
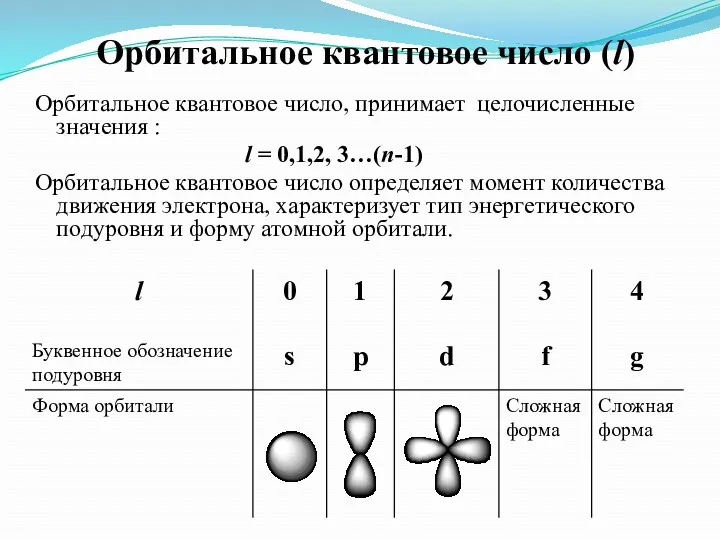
- 6. Орбитальное квантовое число (l) Орбитальное квантовое число, принимает целочисленные значения : l = 0,1,2, 3…(n-1) Орбитальное
- 7. Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например, Т.о., энергетический подуровень – это
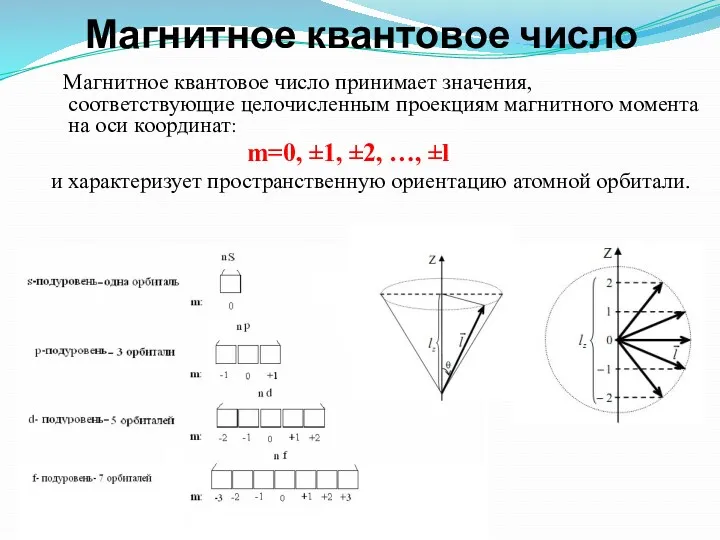
- 8. Магнитное квантовое число Магнитное квантовое число принимает значения, соответствующие целочисленным проекциям магнитного момента на оси координат:
- 9. Оно принимает все целочисленные значения от – l до + l. Например, при l =0 ml
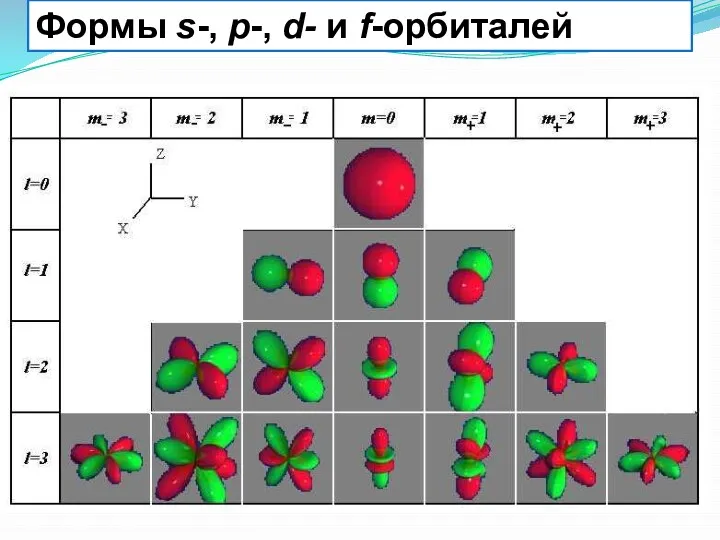
- 12. Формы s-, p-, d- и f-орбиталей
- 13. Спиновое число (s) Спиновое число -«СПИН» - определяется собственным моментом вращения электрона в двух противоположных направлениях.
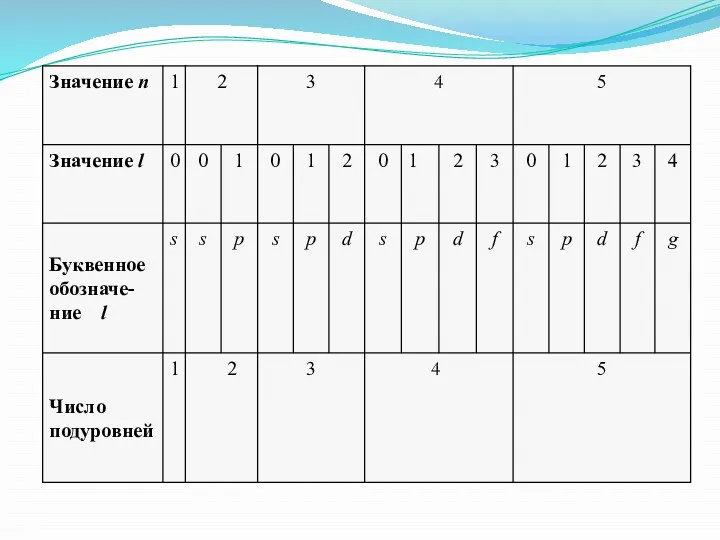
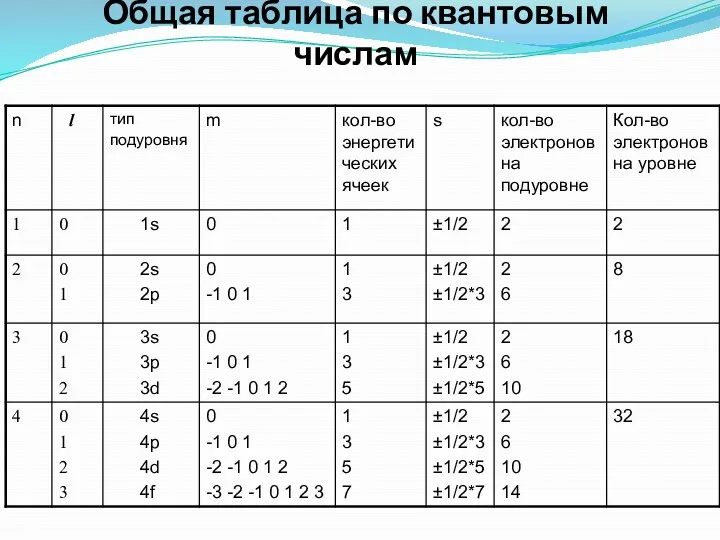
- 14. Общая таблица по квантовым числам
- 15. При составлении электронных конфигураций многоэлектронных атомов учитывают: 1.Принцип минимума энергии 2. Правило Клечковского 3. Запрет Паули
- 16. Последовательность заполнения электронных подуровней 1. Принцип минимума энергии Наиболее устойчивое состояние электрона в атоме соответствует наименьшему
- 17. Применим правило Клечковского …3s 3p 3d 4s 4p… (3+0) (3+1) (3+2) (4+0) (4+1) 3 4 5
- 18. 1s 4d≈5s
- 19. 3. Запрет Паули В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых
- 20. При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда: в пределах энергетического подуровня
- 21. Составление электронных формул 1. полная электронная формула показывает распределение электронов атома по его уровням и подуровням.
- 22. 3. электронная формула в виде энергетических ячеек. Составляется только для сокращенной электронной формулы. Показывает распределение валентных
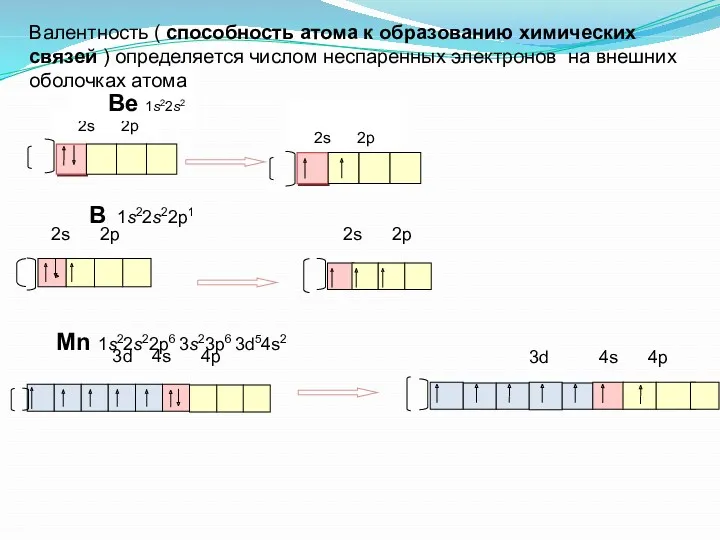
- 23. 2s 2p Ве 1s22s2 В 1s22s22p1 Mn 1s22s22p6 3s23p6 3d54s2 2s 2p 2s 2p 3d 4s
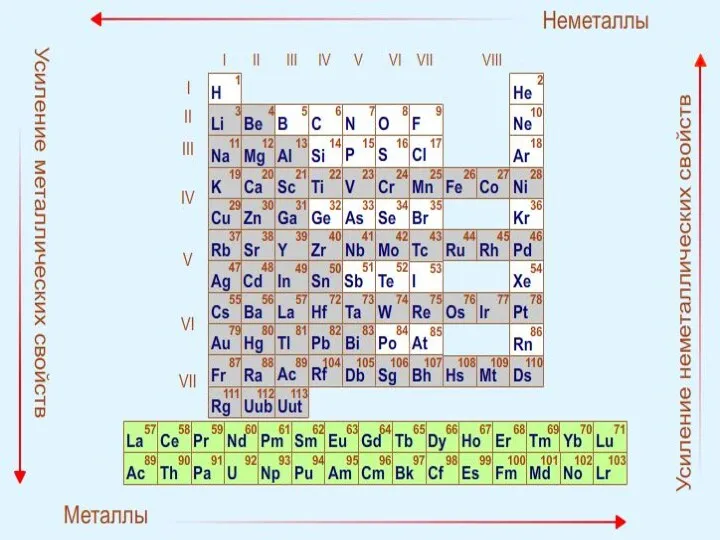
- 24. Периодический закон Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра (порядковый номер).
- 25. Период таблицы Д.И.Менделеева Периодом называется последовательный ряд элементов, размещенных в порядке возрастания заряда ядра атомов, электронная
- 26. Элементы, расположенные в одной подгруппе Периодической системы, являются электронными аналогами. 8O[ ]2s22p6; 16S[ ]3s23p6; 34Se[ ]4s24p6
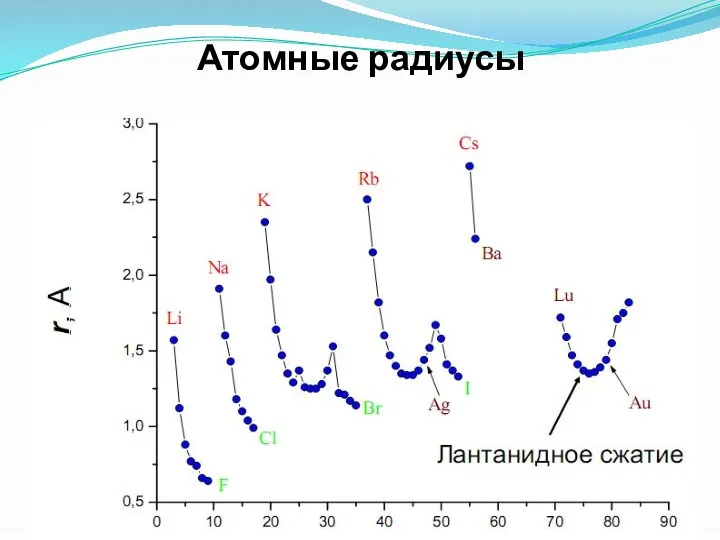
- 28. Атомный радиус Орбитальный атомный радиус- это условная величина, которая равна расстоянию между ядром и самой дальней
- 29. при этом в главных подгруппах такое увеличение происходит в большей степени, чем в побочных подгруппах .
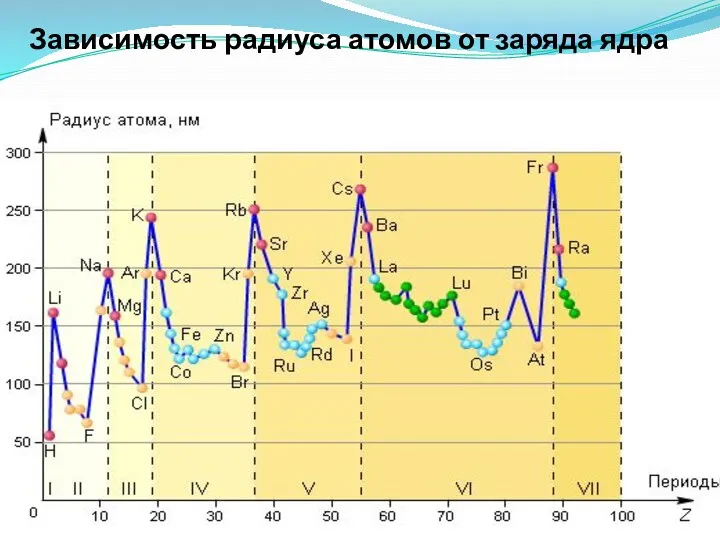
- 30. Зависимость радиуса атомов от заряда ядра
- 31. Атомные радиусы
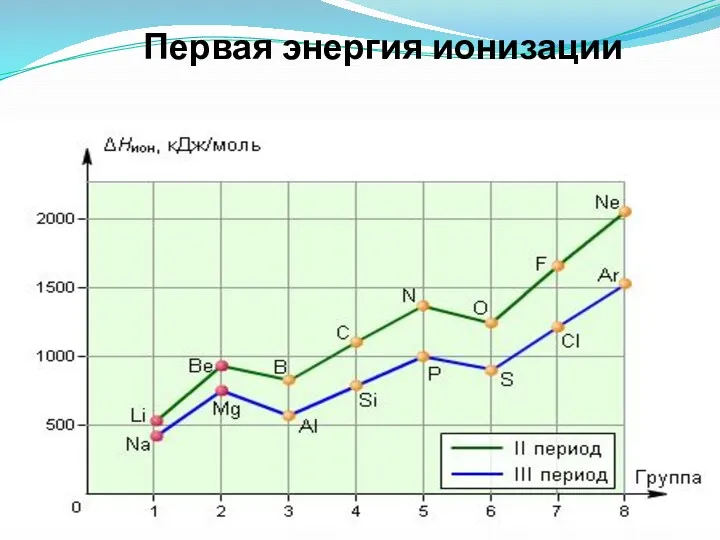
- 32. Энергия ионизации Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома.
- 33. Первая энергия ионизации
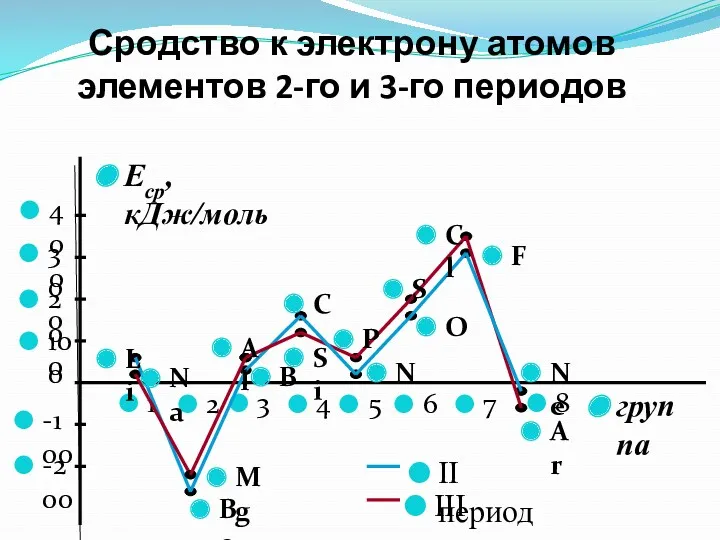
- 34. Сродство к электрону атомов элементов 2-го и 3-го периодов
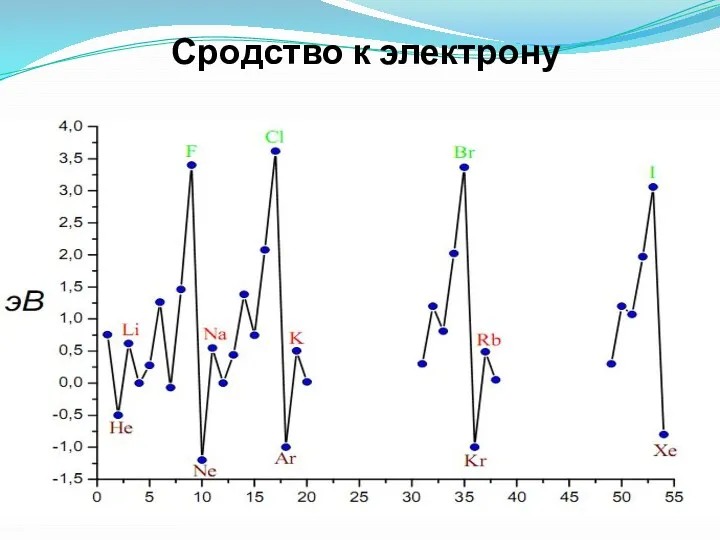
- 35. Сродство к электрону
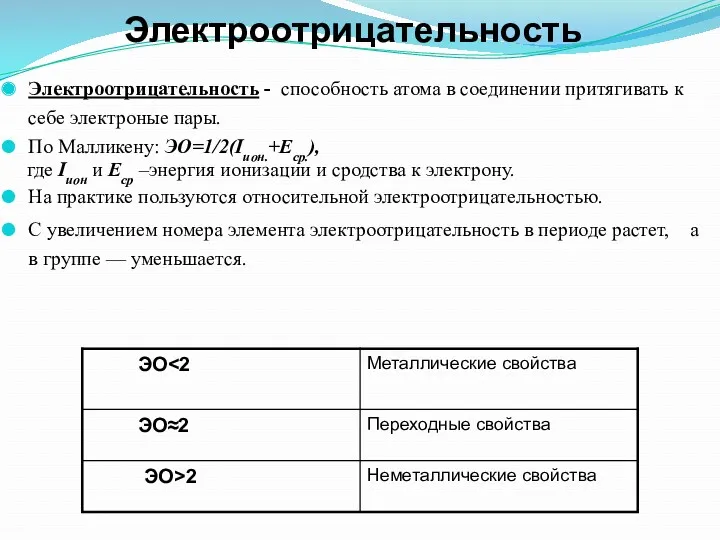
- 36. Электроотрицательность Электроотрицательность - способность атома в соединении притягивать к себе электроные пары. По Малликену: ЭО=1/2(Iион.+Eср.), где
- 37. увеличение уменьшение ОЭО элементов по Л.Полингу
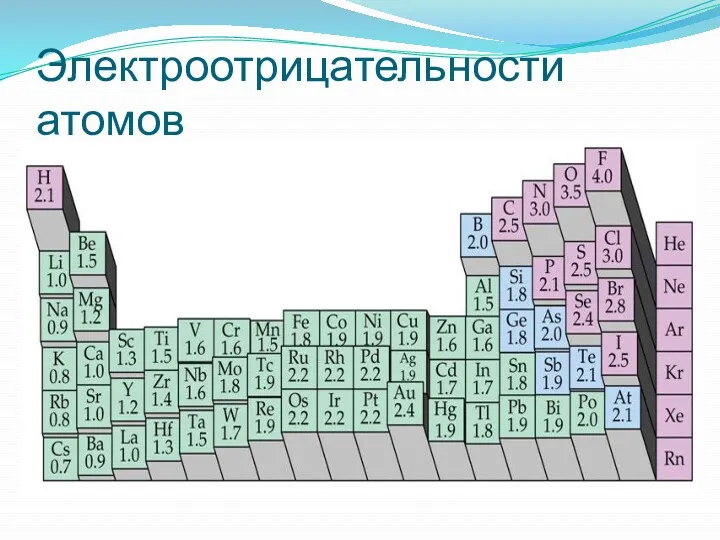
- 38. Электроотрицательности атомов
- 41. Скачать презентацию























 Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость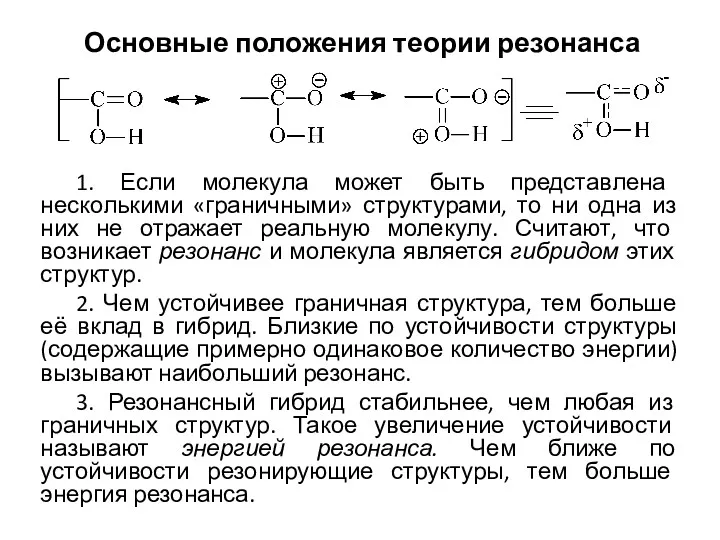 Основные положения теории резонанса
Основные положения теории резонанса Дисахариды, моносахариды
Дисахариды, моносахариды Классификация химических реакций
Классификация химических реакций Химический элемент сера
Химический элемент сера Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості (10 клас)
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості (10 клас) Материаловедение как наука
Материаловедение как наука Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Металлы применяемые в строительстве
Металлы применяемые в строительстве Чистые вещества, смеси
Чистые вещества, смеси Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Речовини. Молекули. Атоми
Речовини. Молекули. Атоми Химическая кинетика
Химическая кинетика Эквиваленты веществ. Жидкое состояние, растворы
Эквиваленты веществ. Жидкое состояние, растворы Магнезит
Магнезит Производство синтетической нефти
Производство синтетической нефти Химический элемент алюминий
Химический элемент алюминий Хімічні явища в побуті. 7 клас
Хімічні явища в побуті. 7 клас Метаболизм углеводов
Метаболизм углеводов Железо и его соединения
Железо и его соединения Химическая кинетика и катализ
Химическая кинетика и катализ Химический элемент фосфор
Химический элемент фосфор Коллигативные свойства растворов
Коллигативные свойства растворов Химические волокна
Химические волокна Соединения химических элементов
Соединения химических элементов Кристалдану үдерісі және қолдланылатын аппараттар
Кристалдану үдерісі және қолдланылатын аппараттар Крахмал. Физические свойства
Крахмал. Физические свойства Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства