Содержание
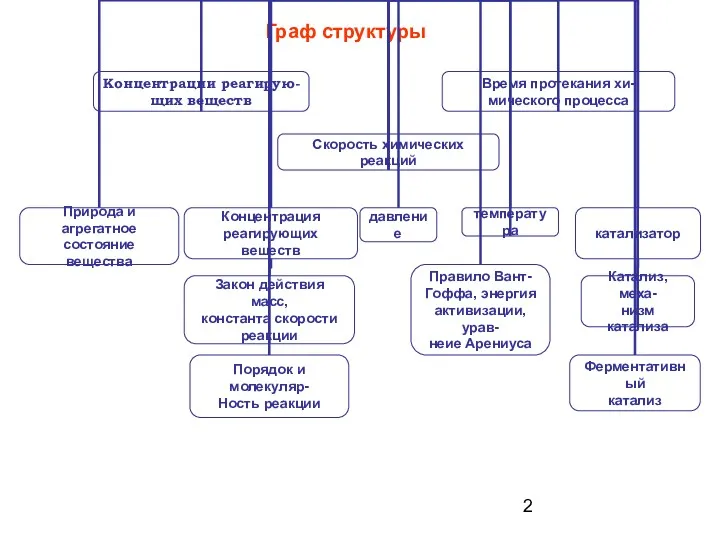
- 2. Граф структуры
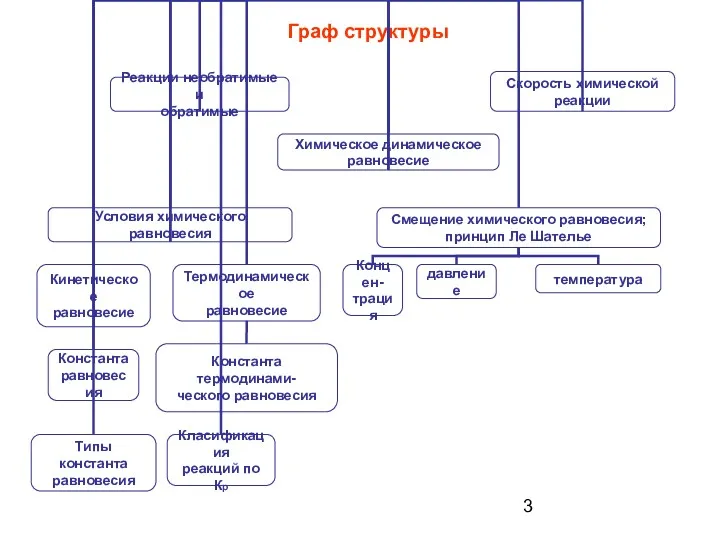
- 3. Граф структуры
- 4. ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ Химическая кинетика - учение о скорости химических реакций и зависимости ее от
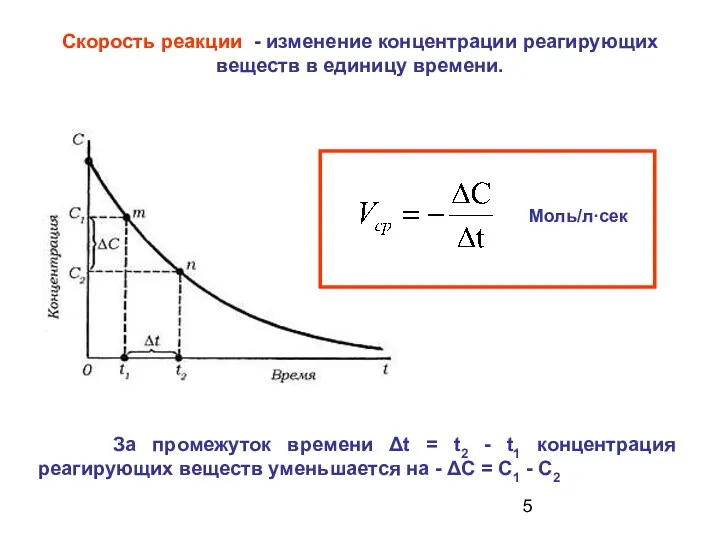
- 5. Скорость реакции - изменение концентрации реагирующих веществ в единицу времени. За промежуток времени Δt = t2
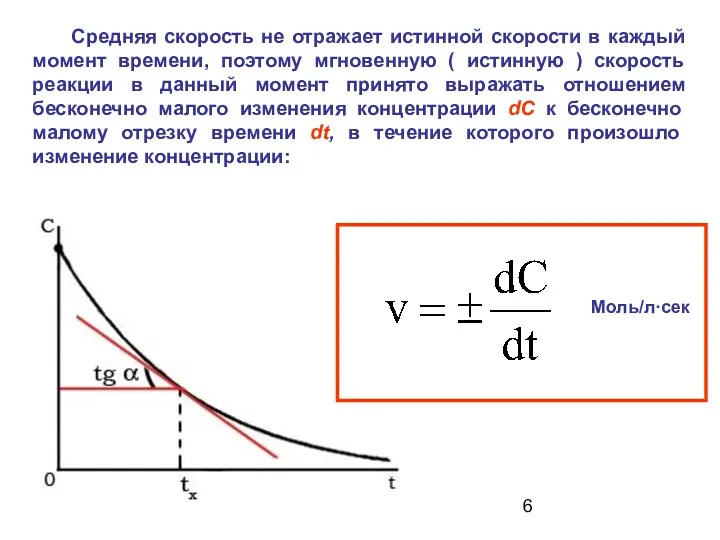
- 6. Средняя скорость не отражает истинной скорости в каждый момент времени, поэтому мгновенную ( истинную ) скорость
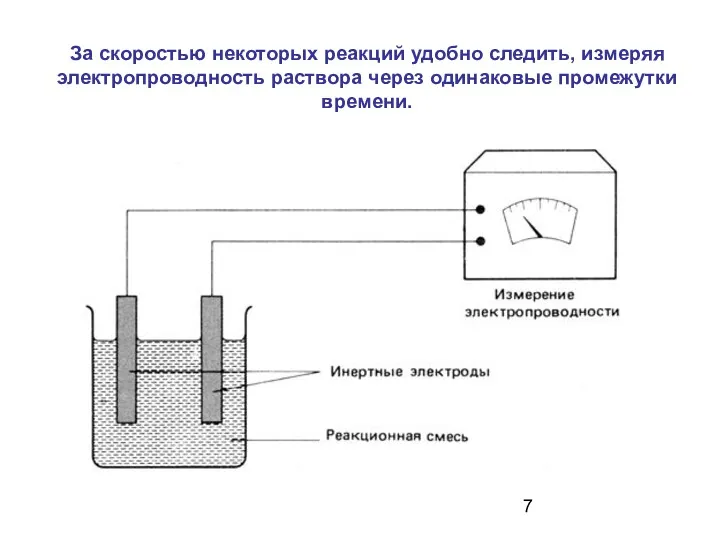
- 7. За скоростью некоторых реакций удобно следить, измеряя электропроводность раствора через одинаковые промежутки времени.
- 8. Классификация химических реакций Молекулярность: Важно, чтобы столкновение произошло теми частями молекулы, которые способны реагировать – стерический
- 9. Влияние стерического фактора при взаимодействии Н2 и I2 Одновременная встреча в элементарном акте трех молекул случается
- 10. Скорость реакции, в целом, определяется лимитирующей стадией - самой медленной стадией реакции.
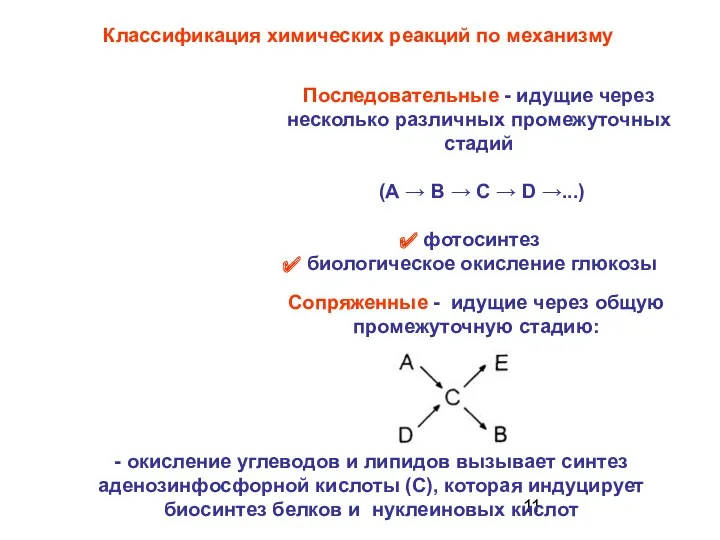
- 11. Сопряженные - идущие через общую промежуточную стадию: Классификация химических реакций по механизму Последовательные - идущие через
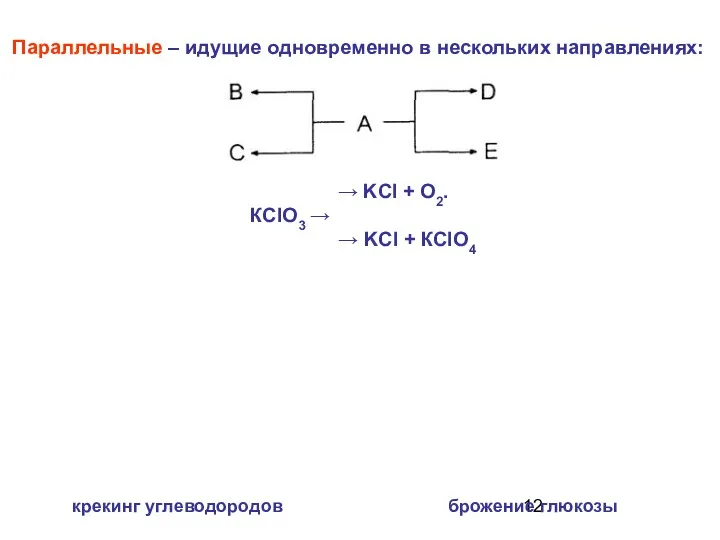
- 12. Параллельные – идущие одновременно в нескольких направлениях: → KCl + О2. КСlO3 → → KCl +
- 13. Цепные - стадии превращения исходных соединений в продукты многократно повторяются: Окончил Петроградский университет в 1917 году.
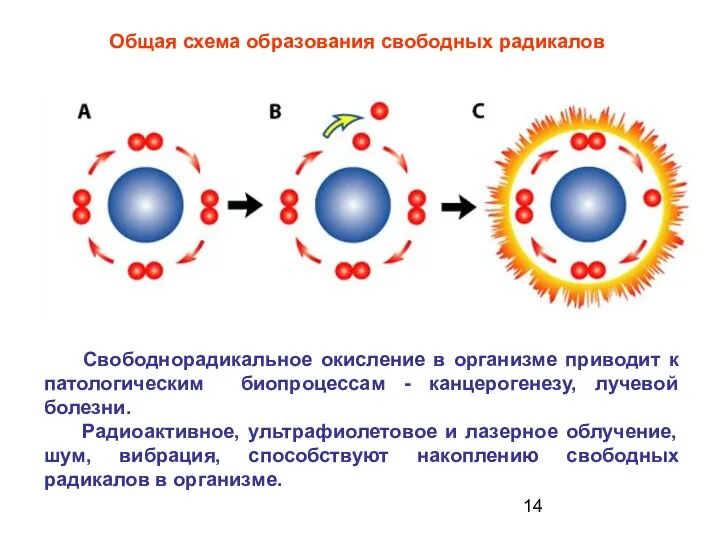
- 14. Свободнорадикальное окисление в организме приводит к патологическим биопроцессам - канцерогенезу, лучевой болезни. Радиоактивное, ультрафиолетовое и лазерное
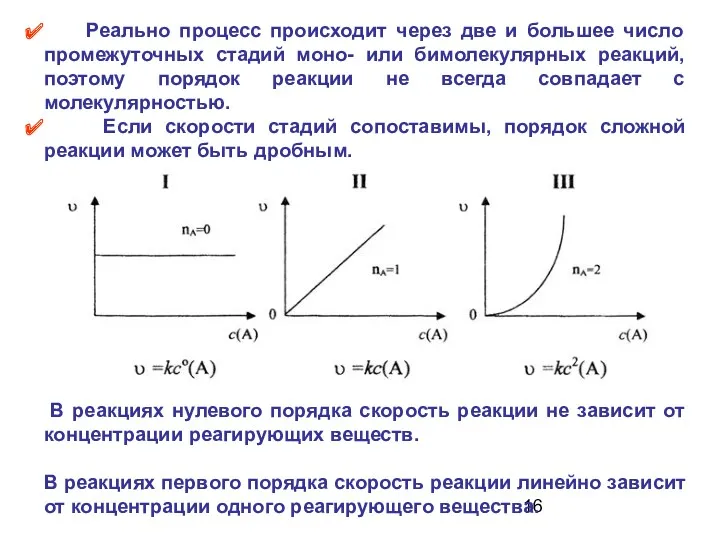
- 15. Порядок реакции Порядок реакции - сумма показателей степеней, с которыми концентрации реагентов входят в экспериментально найденное
- 16. В реакциях нулевого порядка скорость реакции не зависит от концентрации реагирующих веществ. В реакциях первого порядка
- 17. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ГОМОГЕННЫХ РЕАКЦИЙ природа реагирующих веществ концентрация реагентов температура катализатор
- 18. ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ Скорость химической реакции зависит от природы химических соединений, подобно тому, как скорость
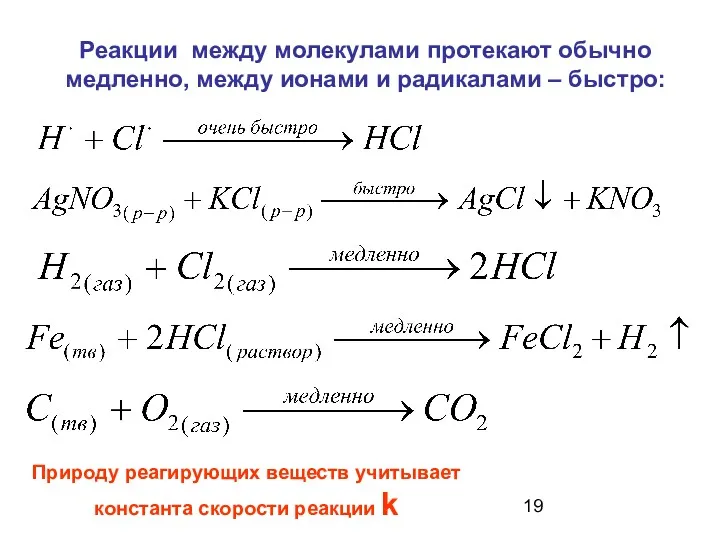
- 19. Реакции между молекулами протекают обычно медленно, между ионами и радикалами – быстро: Природу реагирующих веществ учитывает
- 20. Влияние концентрации реагентов Скорость химической реакции зависит от концентрации реагирующих веществ - чем выше концентрация, тем
- 21. Закон действия масс (ЗДМ) Скорость гомогенной реакции при постоянной температуре пропорциональна произведению молярных концентраций реагирующих веществ,
- 22. k - константа скорости химической реакции (удельная скорость реакции) численно равна скорости химической реакции при концентрациях
- 23. Скорость образования желтого осадка Аs2S3 при пропускании H2S через растворы тиосульфата и арсената натрия разных исходных
- 24. Концентрации твердых веществ в гетерогенных системах не входят в выражение константы химического равновесия, так как они
- 25. Вместе с тем, чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть
- 26. CaCO3(тв) ↔ CaO(тв) + СO2(г)
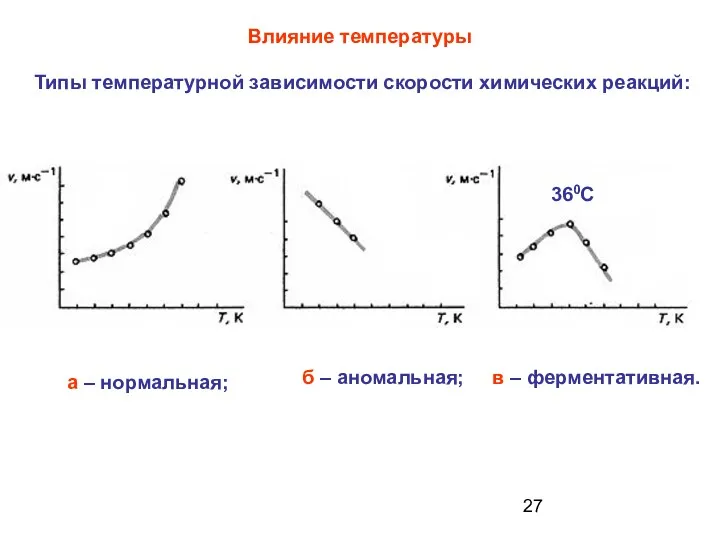
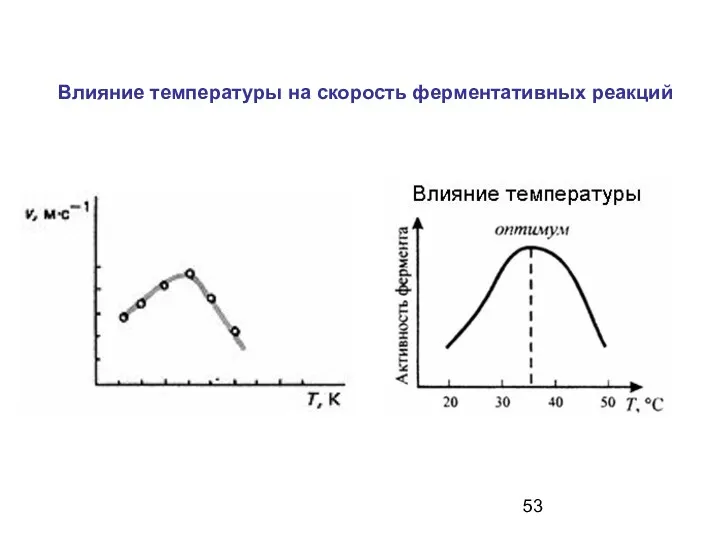
- 27. Влияние температуры в – ферментативная. 360С Типы температурной зависимости скорости химических реакций: а – нормальная; б
- 28. В отличие от большинства химиков своего времени, Вант-Гофф имел основательную математическую подготовку. Она пригодилась ученому, когда
- 29. Невольно большую роль в популяризации новых взглядов Вант-Гоффа принадлежала профессору Г. Кольбе из Лейпцига. В резкой
- 30. Закон Вант-Гоффа При повышении температуры на 10° скорость химической реакции возрастает в два-четыре раза. Если повысить
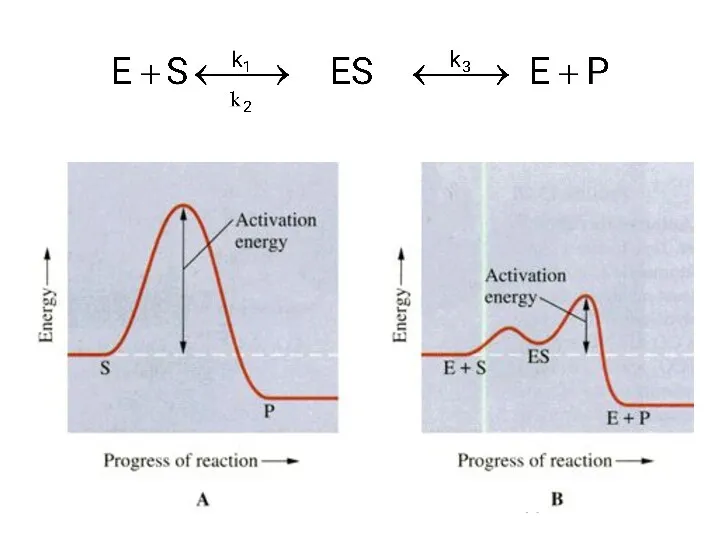
- 31. Рост скорости реакции с температурой объясняется тем, что не всякое столкновение приводит к химическому превращению. Для
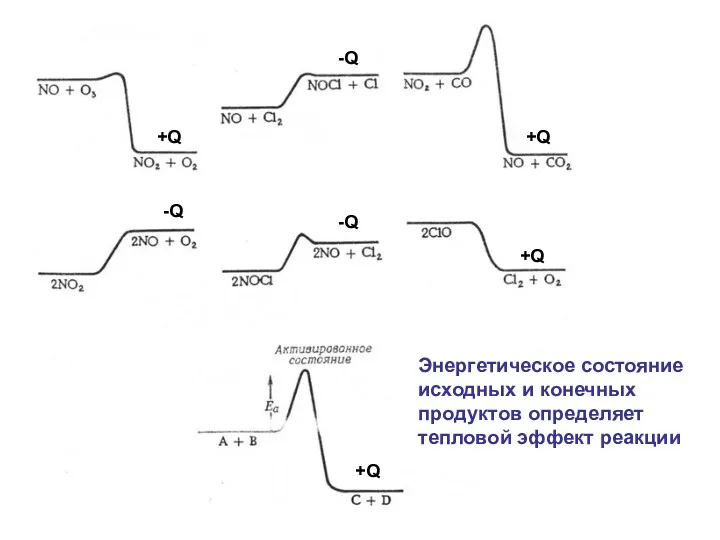
- 32. Энергетическое состояние исходных и конечных продуктов определяет тепловой эффект реакции +Q -Q -Q -Q +Q +Q
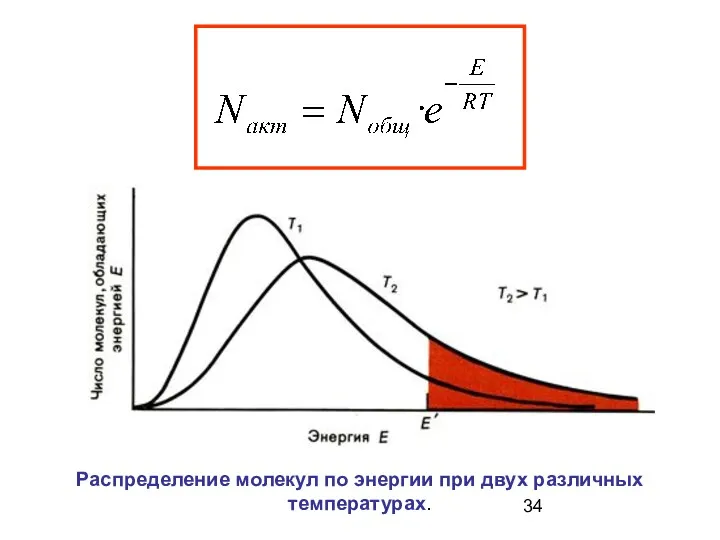
- 33. Зависимость числа активных молекул от температуры N aкт — число активных молекул N o6щ — общее
- 34. Распределение молекул по энергии при двух различных температурах.
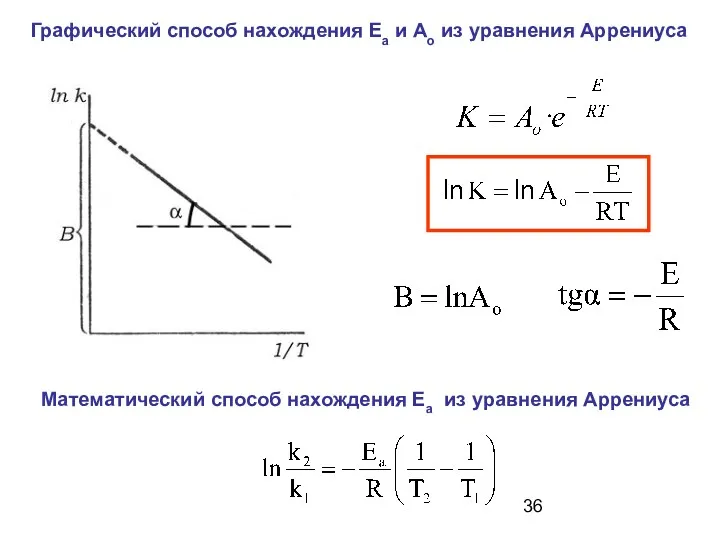
- 35. E — энергия активации К — константа скорости реакции при обычных условиях Ао — число эффективных
- 36. Графический способ нахождения Ea и Ao из уравнения Аррениуса Математический способ нахождения Ea из уравнения Аррениуса
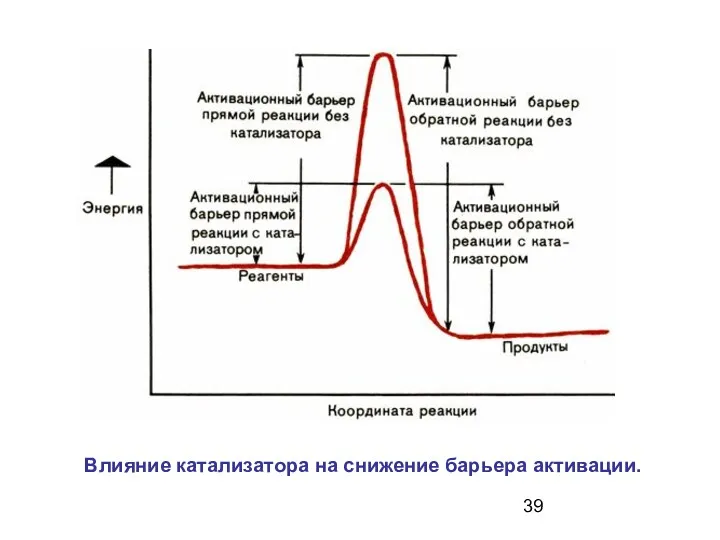
- 37. Катализаторы - вещества, увеличивающие скорость химических реакций Ингибиторы - вещества, замедляющие скорость химических реакций Влияние катализатора
- 38. Катализатор понижает энергетический барьер, его могут преодолеть и молекулы, обладающие малой энергией Роль катализатора заключается в
- 39. Влияние катализатора на снижение барьера активации.
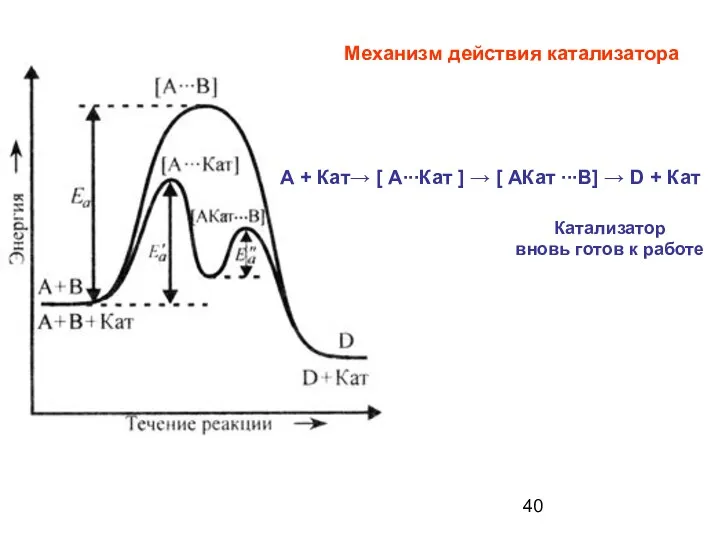
- 40. Катализатор вновь готов к работе Механизм действия катализатора А + Кат→ [ А∙∙∙Кат ] → [
- 41. Из одного вещества можно получить различные продукты в зависимости от катализатора
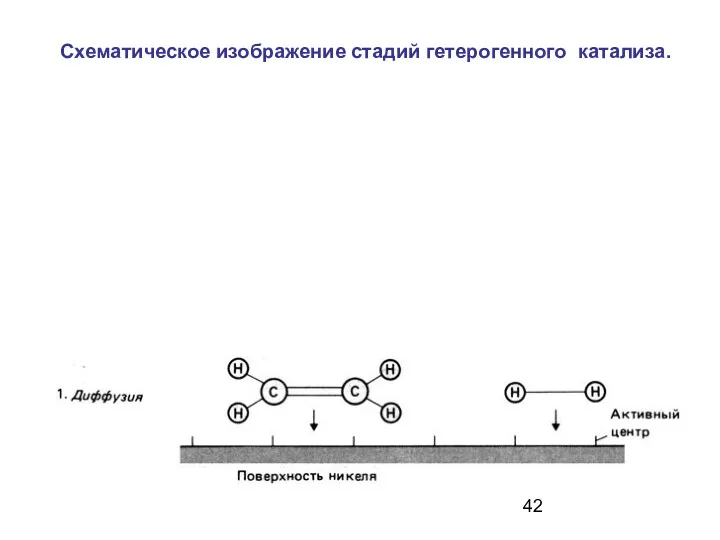
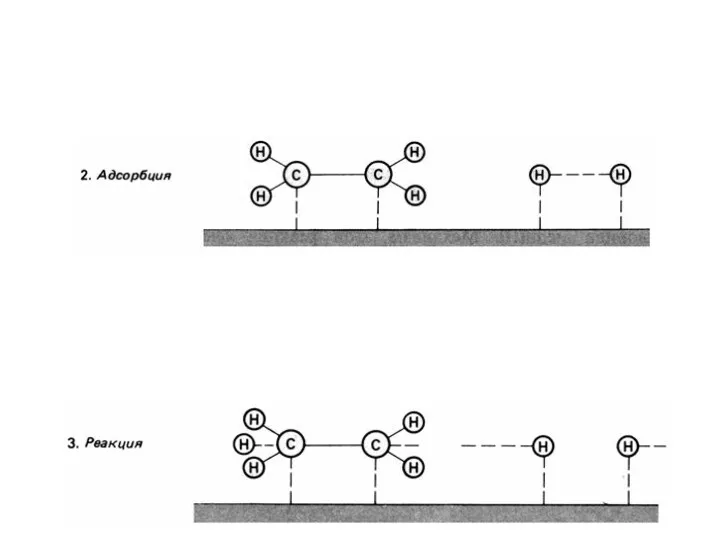
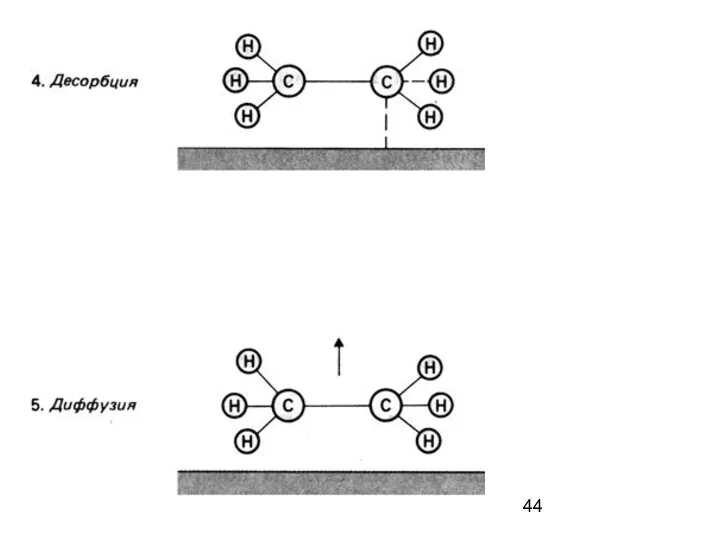
- 42. Схематическое изображение стадий гетерогенного катализа.
- 45. Ферменты (энзимы) – белковые молекулы, которые катализируют химические реакции в живых системах Отличия от химического катализа
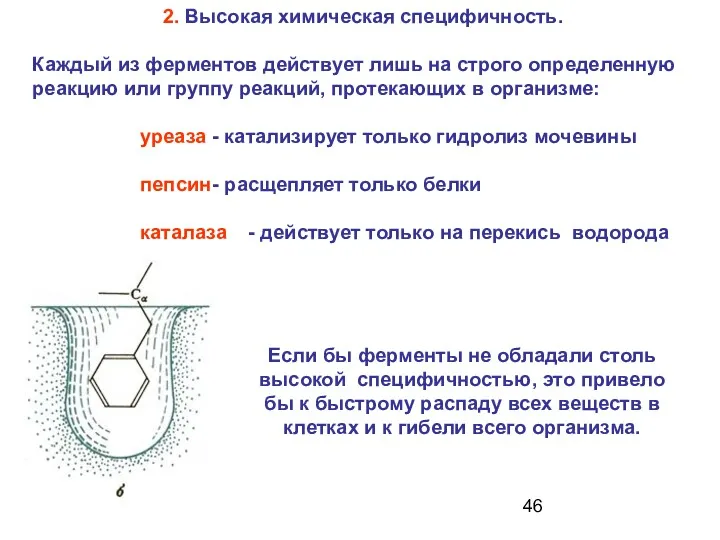
- 46. 2. Высокая химическая специфичность. Каждый из ферментов действует лишь на строго определенную реакцию или группу реакций,
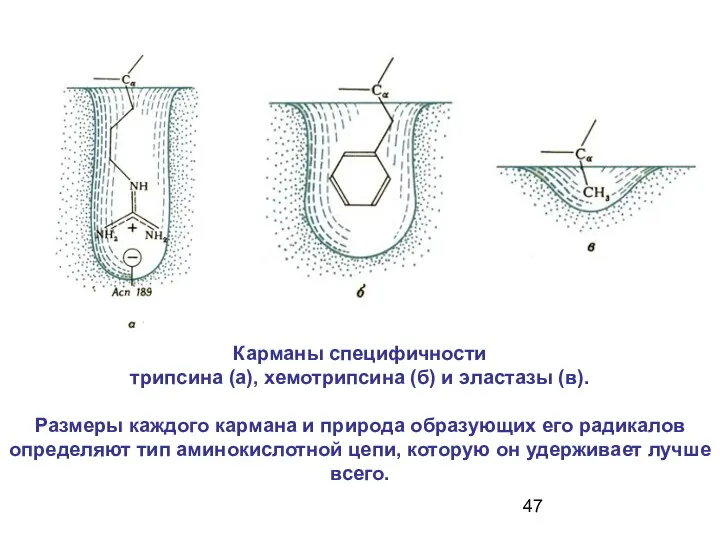
- 47. Карманы специфичности трипсина (а), хемотрипсина (б) и эластазы (в). Размеры каждого кармана и природа образующих его
- 48. В организме человека одновременно функционирует около 1000 различных ферментов.
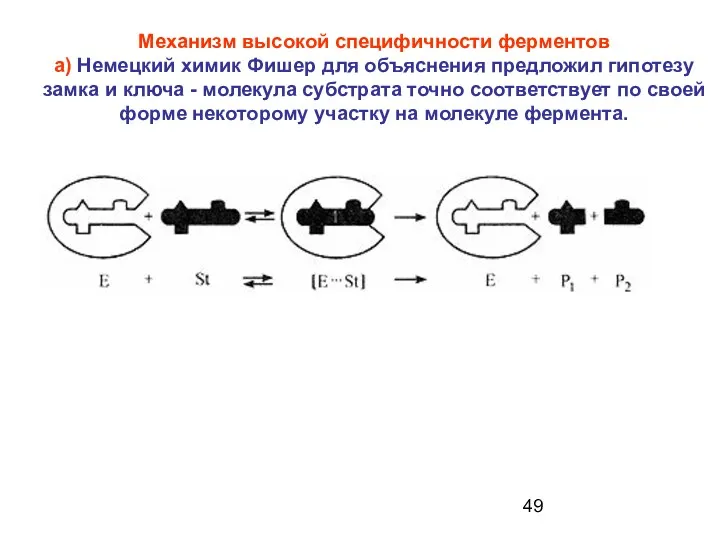
- 49. Механизм высокой специфичности ферментов а) Немецкий химик Фишер для объяснения предложил гипотезу замка и ключа -
- 50. б) Согласно гипотезе Кошланда, субстрат, присоединяясь к активному центру, изменяет его форму, обеспечивая таким образом идеальное
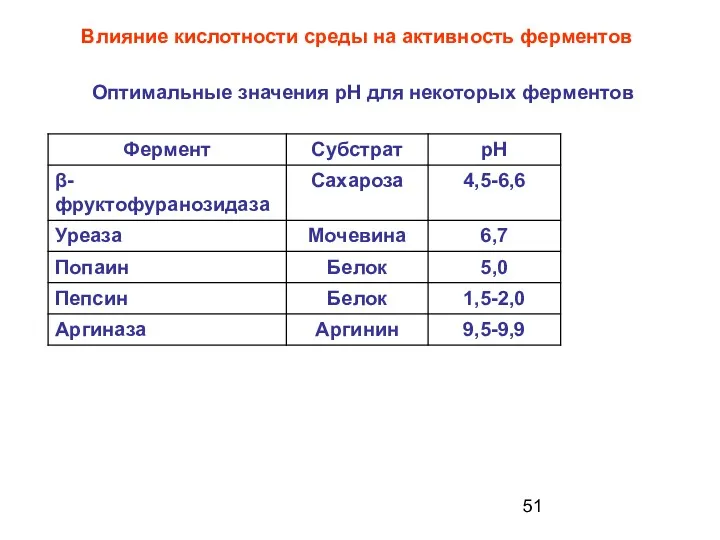
- 51. Влияние кислотности среды на активность ферментов Оптимальные значения рН для некоторых ферментов
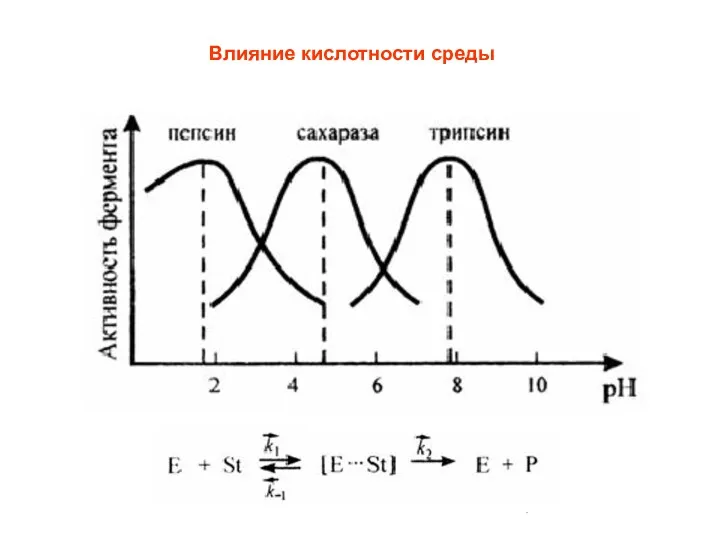
- 52. Влияние кислотности среды
- 53. Влияние температуры на скорость ферментативных реакций
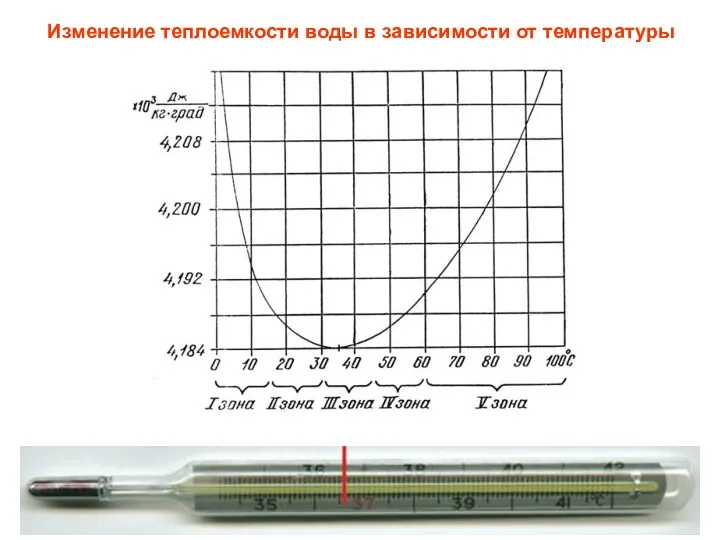
- 54. Изменение теплоемкости воды в зависимости от температуры
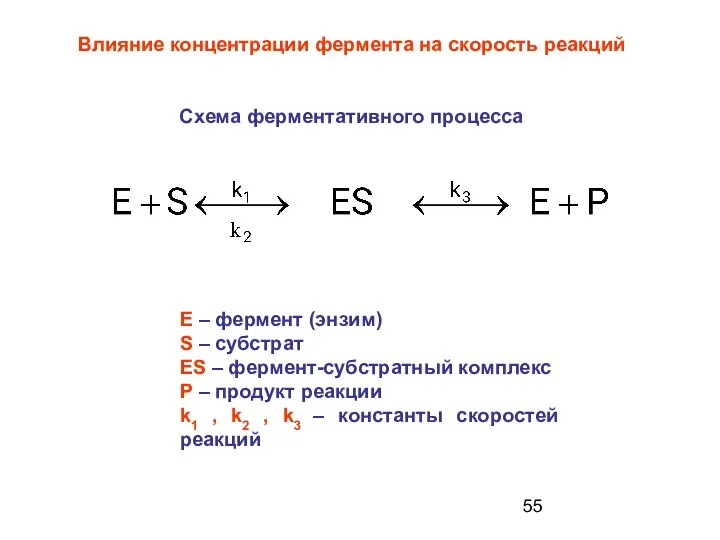
- 55. Влияние концентрации фермента на скорость реакций Схема ферментативного процесса Е – фермент (энзим) S – субстрат
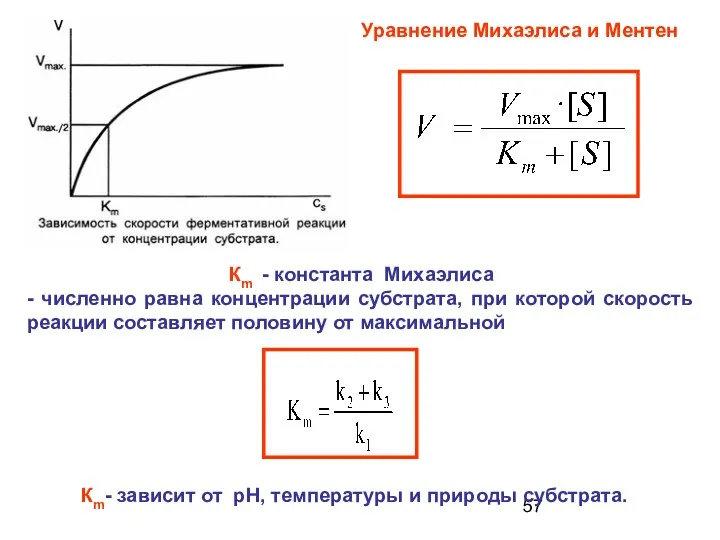
- 57. Кm - константа Михаэлиса - численно равна концентрации субстрата, при которой скорость реакции составляет половину от
- 58. При [ S ] При [ S ] >> Кm При [ S ] = Кm
- 59. Физический смысл константы Михаэлиса Константа Михаэлиса – Кm характеризует сродство фермента к субстрату! Высокое сродство достигается,
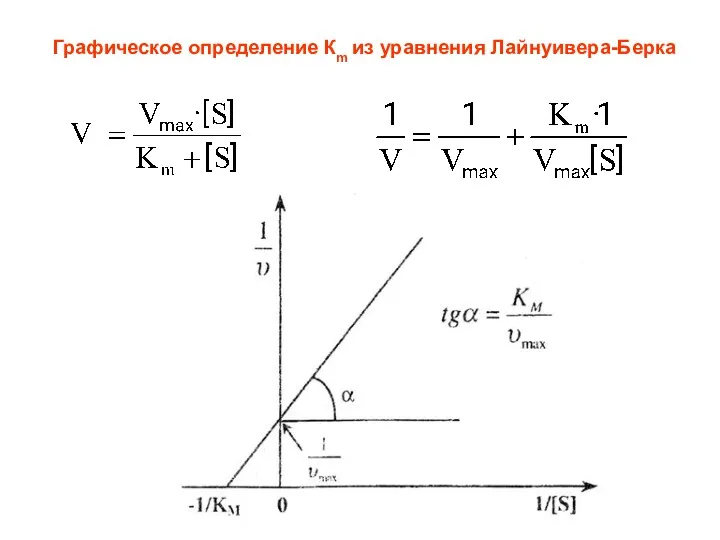
- 60. Графическое определение Кm из уравнения Лайнуивера-Берка
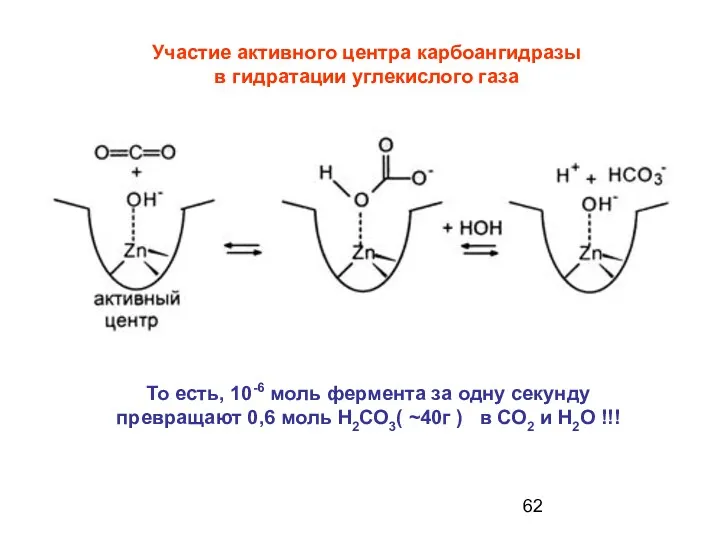
- 61. Для карбоангидразы К3 = 6·105 сек -1 Число оборотов фермента Эффективность ферментативного действия определяется константой k3
- 62. Участие активного центра карбоангидразы в гидратации углекислого газа То есть, 10-6 моль фермента за одну секунду
- 63. Значение ферментативных реакций Применение ферментов в качестве лекарственных препаратов; Разработка методов диагностики с помощью ферментов; Производство
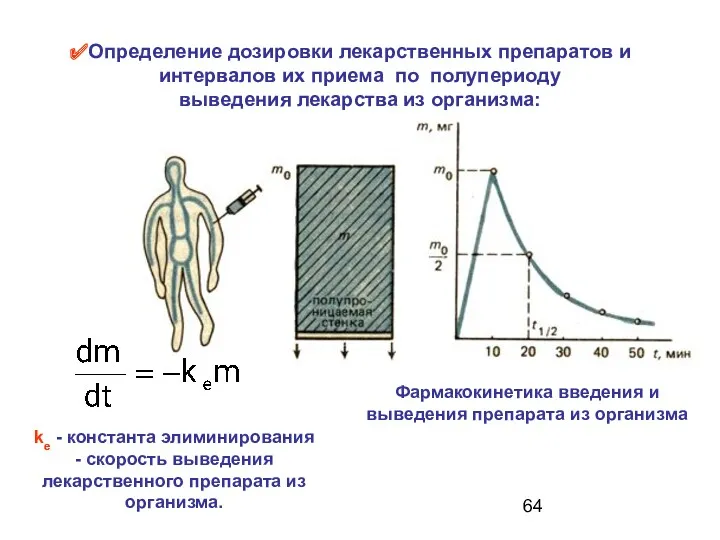
- 64. Определение дозировки лекарственных препаратов и интервалов их приема по полупериоду выведения лекарства из организма: Фармакокинетика введения
- 65. Низкая стабильность ферментов к денатурирующему действию среды (Тo, рН) и значительное снижение их активности при выделении
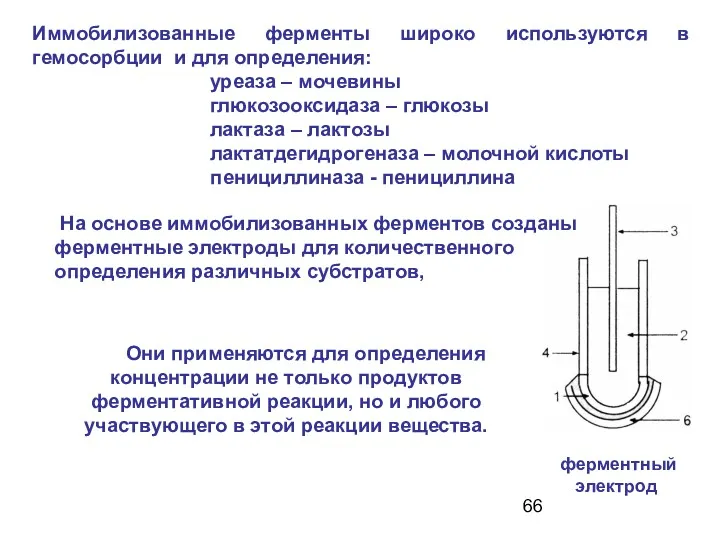
- 66. Иммобилизованные ферменты широко используются в гемосорбции и для определения: уреаза – мочевины глюкозооксидаза – глюкозы лактаза
- 67. Катализаторы и ферменты изменяют скорости и прямой, и обратной реакций, но… не смещают равновесие!!! Достаточно легкого
- 68. Лекция «Химическое равновесие» Кафедра общей и медицинской химии
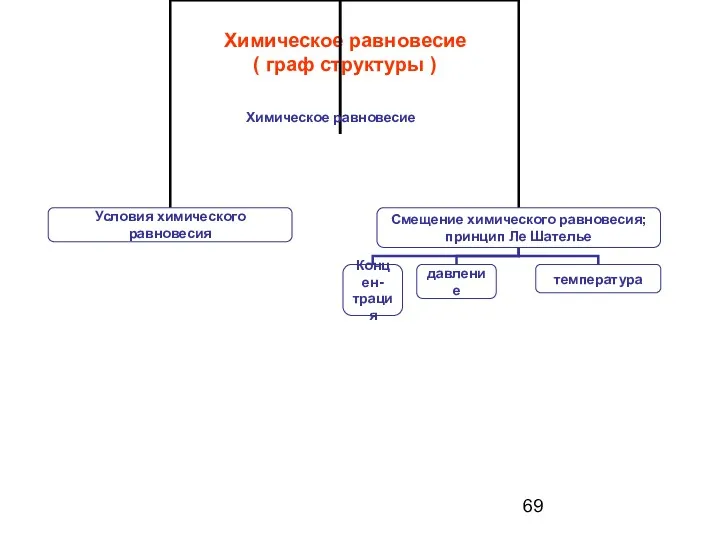
- 69. Химическое равновесие ( граф структуры ) Химическое равновесие
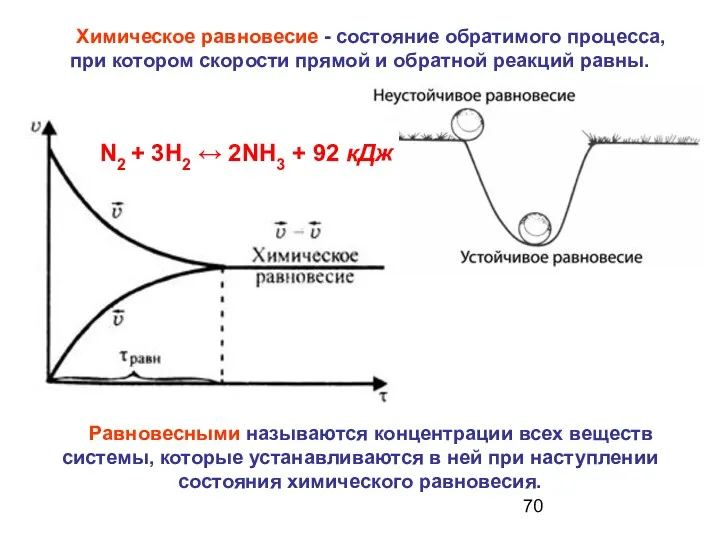
- 70. Химическое равновесие - состояние обратимого процесса, при котором скорости прямой и обратной реакций равны. Равновесными называются
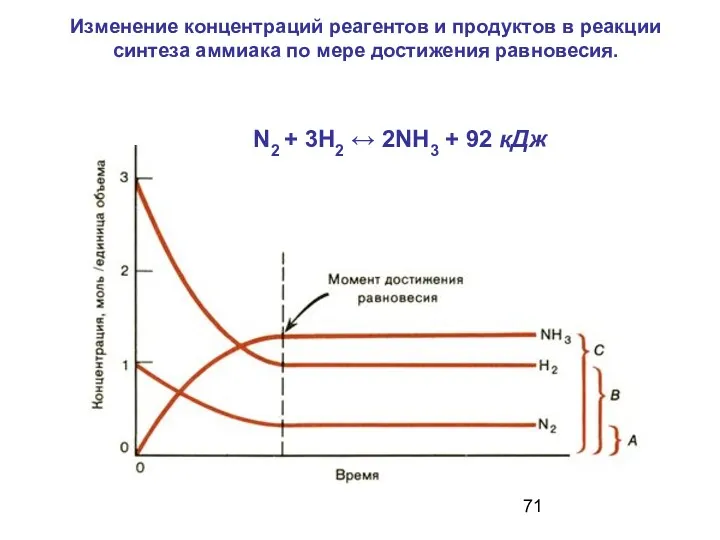
- 71. Изменение концентраций реагентов и продуктов в реакции синтеза аммиака по мере достижения равновесия. N2 + 3H2
- 72. Вывод константы химического равновесия В состоянии химического равновесия: ГУЛЬДБЕРГ Като Максимилиан (2.08.1836-14.1.1902)
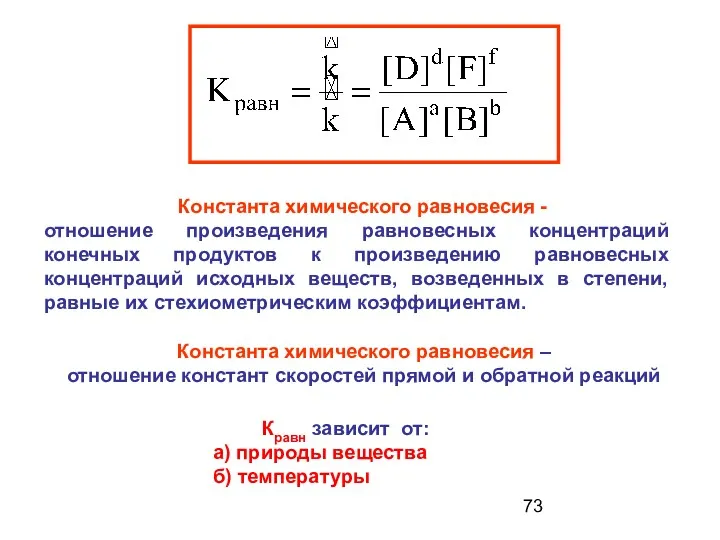
- 73. Константа химического равновесия - отношение произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ,
- 74. Смещение химического равновесия. Анри Ле-Шателье (8.10.1850 – 17.09.1936) Принцип Ле Шателье Если на систему, находящуюся в
- 75. Студенты Сорбонны, слушавшие лекции Ле-Шателье в 1907-1908 годах, так записывали в своих конспектах: "Изменение любого фактора,
- 76. 1. Влияние изменения температуры на смещение равновесия N2 + 3H2 ↔ 2NH3 + 92 кдж Экзотермическим
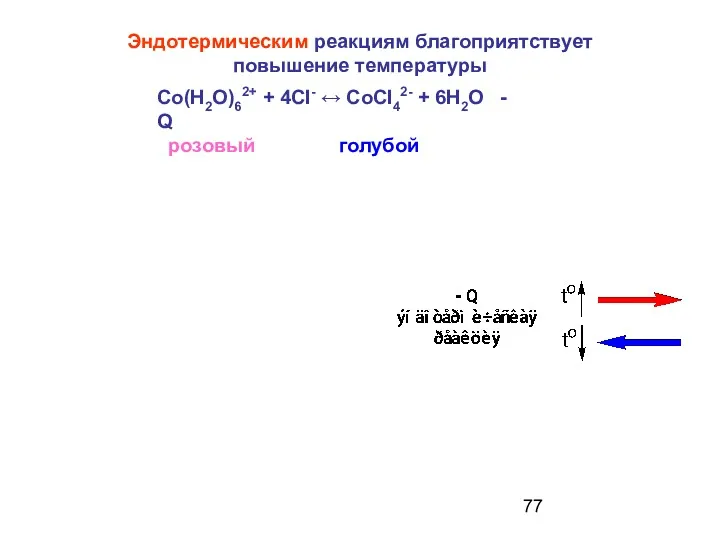
- 77. Со(Н2О)62+ + 4СI- ↔ СоСI42- + 6Н2О - Q розовый голубой Эндотермическим реакциям благоприятствует повышение температуры
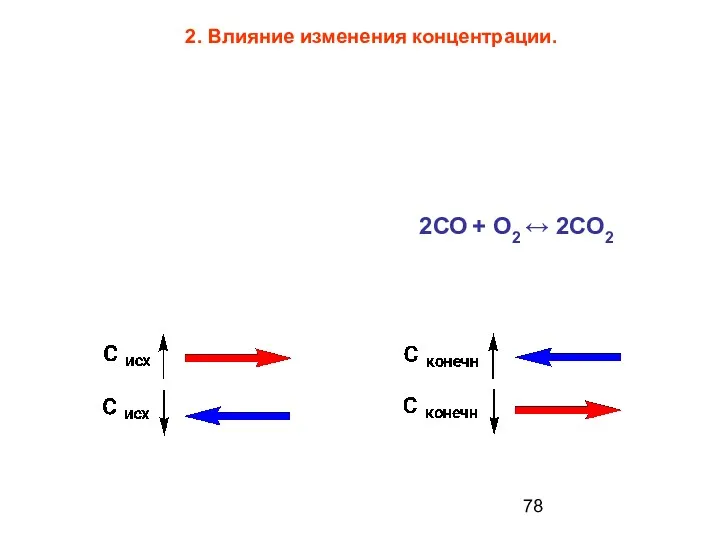
- 78. 2. Влияние изменения концентрации. 2СО + О2 ↔ 2СО2
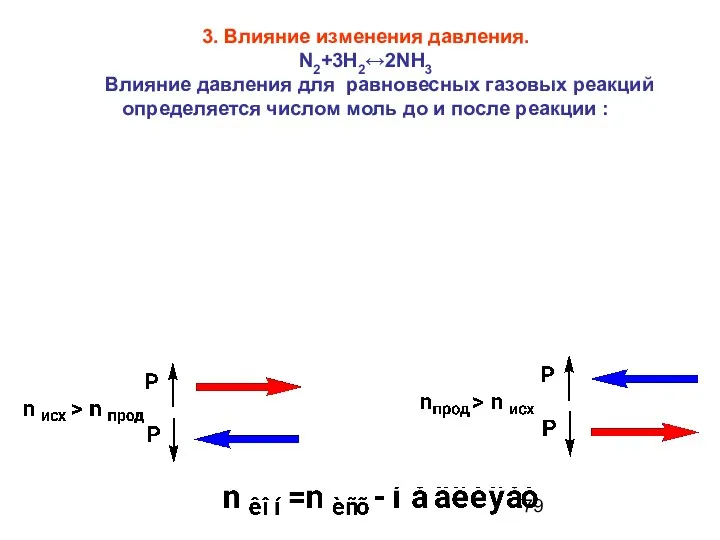
- 79. 3. Влияние изменения давления. N2+3H2↔2NH3 Влияние давления для равновесных газовых реакций определяется числом моль до и
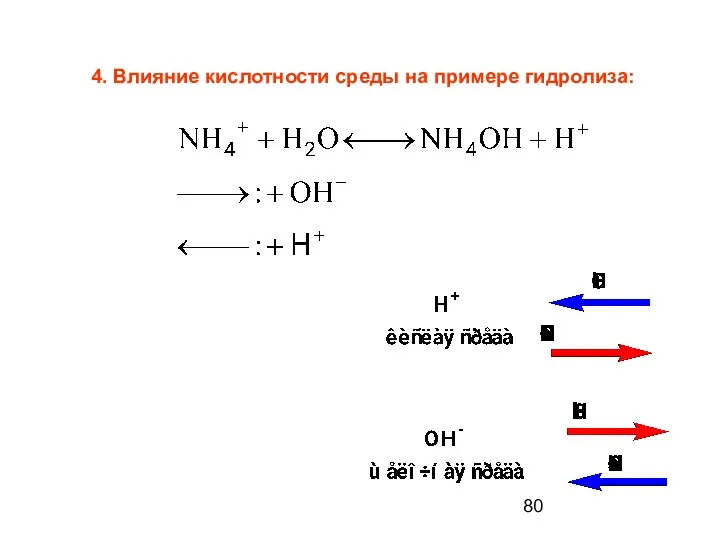
- 80. 4. Влияние кислотности среды на примере гидролиза:
- 82. Скачать презентацию



























![При [ S ] При [ S ] >> Кm](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/286997/slide-57.jpg)










 Разделение углеводородных газов
Разделение углеводородных газов Бутадиеновые каучуки
Бутадиеновые каучуки Решение заданий по теме: Оксиды
Решение заданий по теме: Оксиды Метаморфические породы. (Лекция 10)
Метаморфические породы. (Лекция 10) Химический состав и физические свойства продовольственных товаров
Химический состав и физические свойства продовольственных товаров Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Камни и Козерог
Камни и Козерог Поляризация электродов
Поляризация электродов Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Количество вещества. 8 класс
Количество вещества. 8 класс Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Благородные металлы
Благородные металлы Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл Скорость химических реакций
Скорость химических реакций Галогены (солеобразующие)
Галогены (солеобразующие) Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии Гидролиз солей
Гидролиз солей Влияние циклогексанола селективную очистку масляных фракций нефти N-метилпирролидоном (N-МП)
Влияние циклогексанола селективную очистку масляных фракций нефти N-метилпирролидоном (N-МП) Фенолдар. Анықтама
Фенолдар. Анықтама Витаминные препараты
Витаминные препараты 20230419_gidroliz_soley
20230419_gidroliz_soley Реакции ионного обмена
Реакции ионного обмена Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Химическая связь. Виды химической связи
Химическая связь. Виды химической связи Коррозия металлов. Методы защиты металлов от коррозии
Коррозия металлов. Методы защиты металлов от коррозии