Содержание
- 2. Виды химической связи Химическая связь Ковалентная Ионная Металлическая Водородная Химическая связь – силы, за счет которых
- 3. Ковалентная связь Ковалентная связь – это связь между атомами за счет образования общих связывающих электронных пар.
- 4. Ионная связь Вальтер Коссель (1888-1956)
- 5. Полярность связи. Диполь Электроотрицательность – способность атомов того или иного элемента смещать к себе общую электронную
- 6. Полярная и неполярная КС
- 8. Ковалентная полярная или ионная связь? Ионными соединениями следует считать: Галогениды и оксиды щелочных, щелочноземельных металлов и
- 9. Шкала Полинга
- 10. Шкала Олреда-Рохова
- 11. Физические характеристики некоторых ковалентных связей
- 12. Водородная связь F– H • • • F– –O – H • • • N O
- 13. Водородная связь в органических соединениях Спирты Полярность связи в молекуле спирта Схема образования водородной связи между
- 14. Энтальпия диссоциации водородных связей, объединяющих пАры частиц в газовой фазе, кДж/моль
- 15. Металлическая связь
- 16. Кристаллические решетки Тип кристаллической решетки Частицы в узлах кристаллической решетки Взаимодействие между частицами в узлах решетки
- 17. 1. Определите тип химической связи Металлическая Металлическая кристаллическая решетка Ионная И о н н а я
- 18. А5 Атомную кристаллическую решетку имеет 1) хлороводород 2) вода 3) поваренная соль 4) кремнезем
- 19. А5 Хлорид калия имеет кристаллическую решетку 1) атомную 2) молекулярную 3) ионную 4) металлическую
- 20. A5 Веществами молекулярного строения являются все вещества ряда сахар, сера, поваренная соль поваренная соль, сахар, глицерин
- 21. А5 К веществам с атомной кристаллической решеткой относятся: 1) магний, алмаз, сера 2) бор, алмаз, карбид
- 22. А5-5 Для веществ с металлической кристаллической решеткой нехарактерным свойством является 1) низкая температура кипения 2) теплопроводность
- 23. А5 К веществам с молекулярным строением относятся 1) графит и оксид углерода (IV) 2) вода и
- 24. А5 Молекулярное строение имеет каждое из двух веществ: 1) NH4Cl и CH3NH2 2) C2H5OH и СH4
- 25. Оцените верность суждений
- 26. Задание 1 Верны ли следующие суждения об объеме газов? А. Равные объемы различных газов при одинаковых
- 27. Задание 2 Верны ли следующие суждения о свойствах иодоводородной кислоты? А. Иодоводородная кислота взаимодействует с гидроксидом
- 28. Задание 3 Верны ли следующие суждения об осаждении и растворении сульфидов? А. Сероводород можно получить при
- 29. Произведение растворимости сульфидов
- 30. Сульфидная классификация катионов
- 31. Задание 4 Верны ли следующие суждения о свойствах алюминия? А. Алюминий вытесняет медь при взаимодействии с
- 32. Верны ли суждения?
- 33. Задание 5 Fe + HNO3 (конц.) = ? График. Содержание продуктов восстановления азотной кислоты в реакции
- 34. С2 в старой формулировке Даны вещества: азотная кислота (конц.) Растворы: карбоната калия сульфида натрия хлорида железа(III)
- 35. HNO3(конц.),K2CO3, Na2S, FeCl3 2HNO3 + K2CO3 = 2KNO3 + CO2↑ + H2O 2HNO3 + Na2S =
- 36. HNO3(конц.),K2CO3, Na2S, FeCl3 2HNO3 + K2CO3 = 2KNO3 + CO2↑ + H2O 4HNO3 + Na2S =
- 38. Скачать презентацию



































 Edexcel organic reaction mechanisms
Edexcel organic reaction mechanisms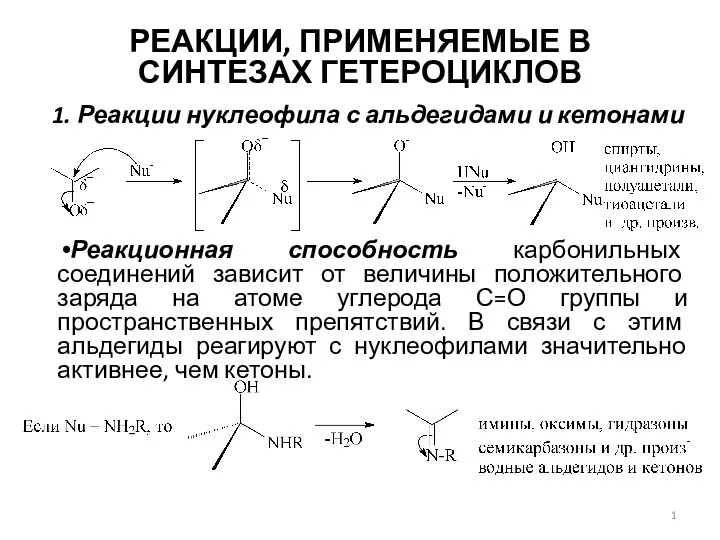 Реакции, применяемые в синтезах гетероциклов
Реакции, применяемые в синтезах гетероциклов Неметаллы. Азот
Неметаллы. Азот Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении
Общее понятие напряженно – деформированного состояния деталей машин из металлических материалов, применяемых в машиностроении Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики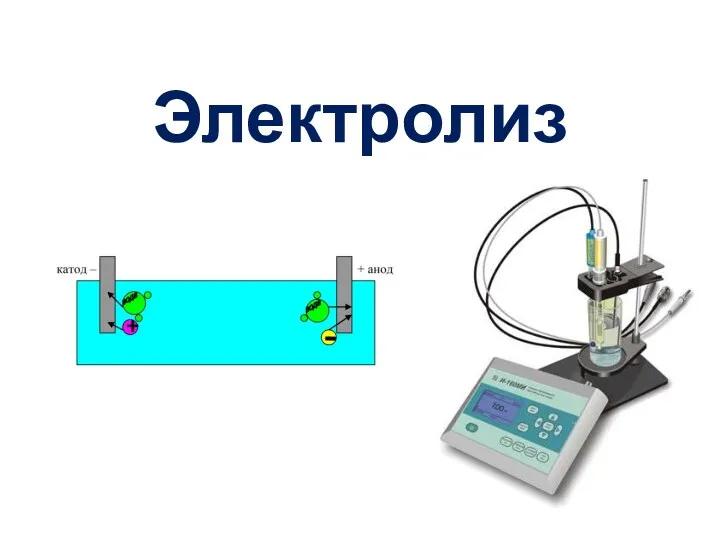 Электролиз – ОВ процесс
Электролиз – ОВ процесс Нитраттарды қолдану
Нитраттарды қолдану Углеводы. 10 класс
Углеводы. 10 класс Токсикология пестицидов
Токсикология пестицидов Некоторые d-элементы
Некоторые d-элементы Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Элемент цинк
Элемент цинк Кто хочет стать химиком
Кто хочет стать химиком Элементы IV А - группы
Элементы IV А - группы Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Использование кубового остатка ректификации стирола в процессах получения нефтяных дорожных битумов
Использование кубового остатка ректификации стирола в процессах получения нефтяных дорожных битумов Количественный анализ. Титриметрический анализ
Количественный анализ. Титриметрический анализ Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения
Неметаллы. Элементы V группы главной подгруппы. Пниктогены. Соединения Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2 Водород - топливо будущего
Водород - топливо будущего Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Кафедра химической технологии лекарственных веществ (ХТЛВ)
Кафедра химической технологии лекарственных веществ (ХТЛВ) Углерод
Углерод Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Кевлар. Структура кевлара
Кевлар. Структура кевлара Концентраційні межі поширення полум'я. Лекція 7
Концентраційні межі поширення полум'я. Лекція 7